手性砜类化合物广泛存在于生物活性分子中,并且该类化合物也是重要的药物中间体,可以发生烷基化,卤化,氧化,脱砜化以及Julia烯化实现官能团转化。因此,砜类化合物的对映选择性合成具有非常重要的意义。在过去的文献报道中,关于该类化合物的合成方法有: α-溴代砜的不对称芳基化/烯化;金属钌和有机催化不饱和砜的不对称共轭加成;潜手性砜的不对称自由基加成和不对称还原。已经报道的方法中,金属催化潜手性不饱和砜的不对称还原是一种最直接的方法来合成手性砜,然而,通过不对称氢化来实现手性砜类化合物的合成,目前只有几例报道,并且底物范围有限。对于一些具有芳香体系大位阻不饱和砜的不对称氢化是具有很大挑战性的。早在2014年,Hou小组报道合成了1,1′-螺茚满骨架的手性双膦配体f-spiroPhos,之后将其成功用于多类底物的氢化,包括不饱和腈类,羧酸以及亚胺类底物。最近,该小组将这种高效配体用于一些具有挑战性的不饱和砜类化合物的不对称氢化中,首次实现了3,3-二芳基以及环外不饱和砜的高对映选择性不对称氢化,最高可以取得99%的ee值。
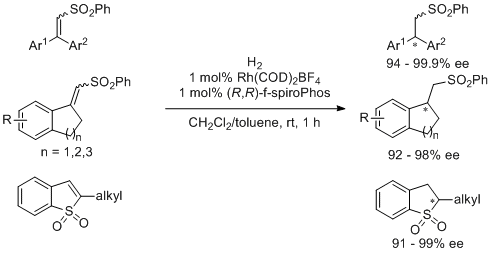
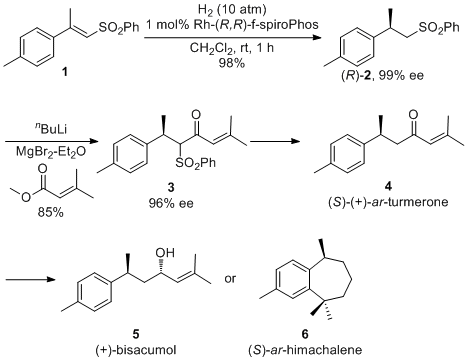
该反应条件温和,底物普适性好,并且可以进行放大实验。之后作者将该反应成功应用于为香精兼药物中间体(S)-(+)-arturmerone的合成中。
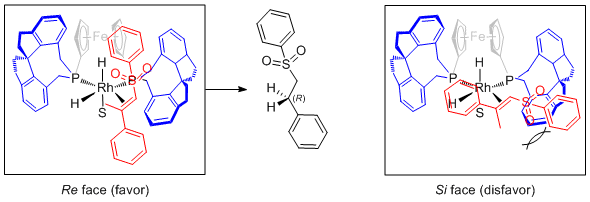
根据产物的绝对构型和已经报道的钌和铱催化不饱和砜的不对称氢化机理,作者提出的过渡态模型如下: f-spiroPhos配体中的茂环挡住了该络合物的一面,阻止了底物从该方向与之配位,底物只能从相反方向与铑配位,配体和大的砜基之间的空间排斥使得铑进攻(E)式α,β不饱和砜的Re面比Si面更加有利,从而生成R型产物。( J. Am. Chem. Soc. 2019, 141, 1749)HX