化合物中活性较低的C-H键直接官能化策略在天然产物和药物合成化学中扮演着日益重要的角色。其中,金属卡宾的不对称插入反应近年来取得了令人瞩目的快速发展,尤其是Donor-Acceptor型卡宾前体重氮化合物参与的C-H键插入反应获得了较高的选择性。然而,对于另外一类结构更为简单的Acceptor-Only型偶氮卡宾前体化合物,其参与的对映选择性C-H键官能化反应仍未见报道。这类金属卡宾具有更高的反应活性,卡宾迁移过程的能垒更低,不利于反应中选择性的调控。此外,该类卡宾由于其自身特点,不具有潜手性结构,催化剂对于反应的选择性控制需要通过营造精密的手性环境对另一反应物的调控来实现。
最近,埃默里大学的Davies小组首次实现了重氮乙酸酯参与的环醚类化合物α位不对称C-H键官能化反应,使用一系列1,3-二氢异苯并呋喃及2,5-二氢呋喃作为反应物均可以给出中等以上的反应收率和较好的对映选择性。作者提出:第六周期过渡金属可提供较强的反馈键,降低Acceptor-Only型金属卡宾的亲电活性,提高随后迁移步骤的能垒,有利于反应中的手性控制。此前,该小组在铱催化Donor-Acceptor型金属卡宾的不对称C-H键官能化反应中取得了不错的反应结果。结合实验优化和计算化学结果,作者设计并合成了一系列新型咪唑啉配体,进一步提高了反应的对映选择性。
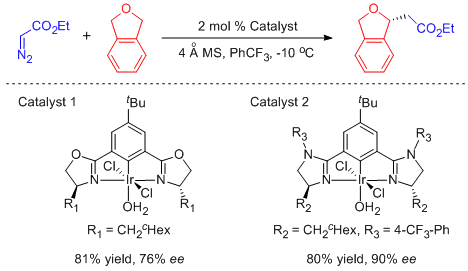
在机理研究中,作者以四氢呋喃与重氮乙酸乙酯的反应作为研究对象,与该小组此前发展的铑催化四氢呋喃与Donor-Acceptor型重氮底物反应相比,动力学同位素效应实验给出相似结果。因此,作者提出反应中可能经历了类似的协同C-H键插入历程。(Chem. Sci., 2016, DOI: 10.1039/C6SC00190D) (刘聪 推荐)
