具有全碳中心的手性酮是重要的有机合成子,广泛应用于天然产物、药物及材料的合成。然而,全碳手性中心的构建在有机合成中具有非常大的挑战,尤其是对于酮的α位全碳手性中心的构建。近年来,化学家们一直致力于该领域的研究,相关文献已经报道许多。其中催化不对称α-芳基化和α-酮烯酸酯的烷基化被证明是构建手性酮最有效的方法,但是该方法仍存在一定的缺陷。例如:为避免区域选择性问题,通常使用的酮是α位具有单烯化的底物或预先制备的烯醇化合物,并且是立体选择性较好控制的环酮或四取代烯酸酯;另外,对于α,α-二取代芳基酮的全碳手性中心的构建比较困难,至今仍未解决。针对这些问题,作者采用House-Meinwald重排策略,以四取代环氧为底物,在手性磷酸的催化下高效构建了含有全碳手性中心的α,α-二取代芳基酮。该方法具有以下优点:1)底物范围广;2)较高的对映选择性及区域选择性;3)催化剂高效控制产物的对映选择性并且能够快速构建全碳手性中心。

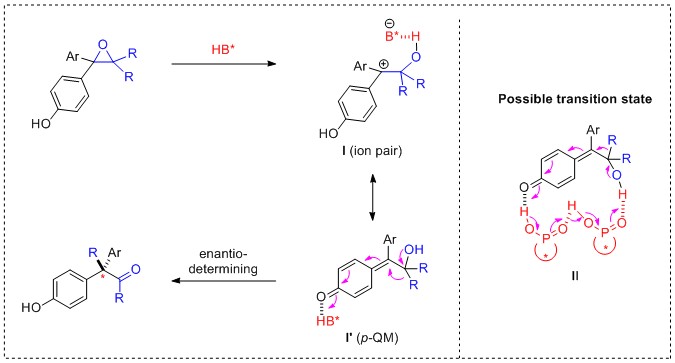
作者通过实验证明,提出可能的反应机理:首先,底物在手性磷酸的活化下,生成手性离子对I,然后经过电子转移形成对苯醌伪共振式Iꞌ,随后基团迁移重排经过渡态II,最终得到目标产物手性酮。文章总共拓展了26个例子,产物对映选择性最高达97%。(J. Am. Chem. Soc. 2019, 141, 13783-13787.) (推荐人:李翔 审查人:翟小勇)