现代有机化学中,含磷有机化合物应用非常广泛,是重要的合成试剂,材料科学中的关键组分,过渡金属催化反应中的核心配体。其中,1,2-双(二苯基膦基)乙烷(DPPEs)由于其独特的刚性螯合配位特性,成为目前多种不同过渡金属催化反应中最具代表性的双齿配体之一。
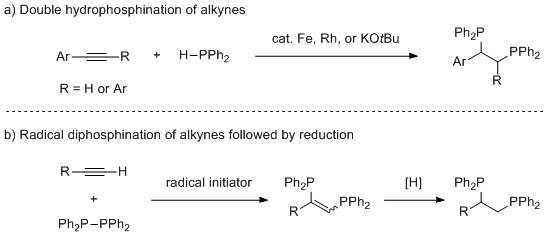
在DPPE类型配体的众多合成方法中,含磷官能团对碳-碳不饱和键的加成反应受到广泛关注,通过简单易得的起始原料出发,能够构建一系列该类化合物。Nakazawa小组实现了无溶剂条件下铁催化末端炔烃与二苯基膦的二次加成反应,尽管存在双膦产物对催化剂毒化的问题,但该反应仍能取得较好的转化率。Giuseppe,Castarlenas和Oro等人也发展了铑/氮杂环卡宾催化的此类转化反应。对于特定底物,叔丁醇钾也可以促进该类反应的发生。另外,在自由基引发试剂存在的条件下,末端炔烃与双膦化合物反应,随后经过还原反应也能得到该类双膦产物。
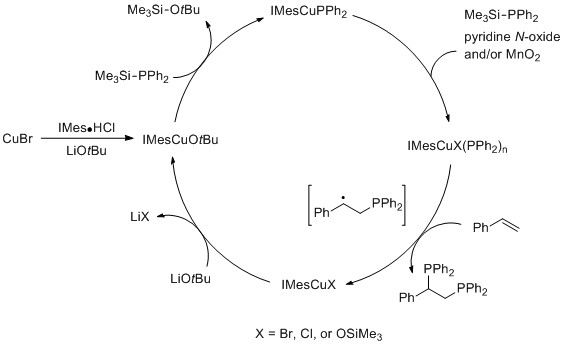
最近,日本大阪大学Hirano和Miura研究小组发展了一种铜/氮杂环卡宾催化下取代苯乙烯的双二苯基膦化反应,在叔丁醇锂作为碱和吡啶氮氧化物与二氧化锰作为共氧化剂的条件下,合成了一系列1,2-双(二苯基膦基)乙烷衍生物。与其他催化体系相比,该催化体系可以从廉价的烯烃原料出发,在室温条件下进行反应。

为了验证催化反应机理,该小组进行了一系列对照实验。研究表明:在卡宾配体存在下,溴化亚铜与叔丁醇锂发生盐复分解,得到活性铜催化剂。接下来,在氧化剂的辅助下,经过与二苯基膦转移试剂的多次配体交换,获得高价铜-膦活性物种。随后,作者提出该高价铜-膦活性物种可能发生Cu-P键均裂,随后对烯烃底物进行加成,经过苄基自由基中间体,最终获得目标产物,铜-卡宾物种重新回到催化循环中。反应机理中的细节仍需更多的实验结果支持。(Angew.Chem. Int. Ed. 2016, 55, 13558.)