吲哚里西啶和喹诺里西啶类化合物作为N-杂环片段广泛存在于生物活性分子中,发展合成此类化合物的有效方法已经引起了化学家们广泛的关注。Aza-Sakurai环化反应是亚胺离子与烯丙基硅烷发生的一种分子内反应,它是构建N-杂环的有效方法,而且,非对映选择性Aza-Sakurai环化反应能够有效的合成天然生物碱以及相关的化合物。最近,不对称的阴离子络合催化已经成功的应用到了一系列亲核试剂,如甲硅烷基烯酮缩醛类化合物,吲哚类化合物和多烯类化合物,对N-酰基亚胺正离子的对映选择性加成反应中。
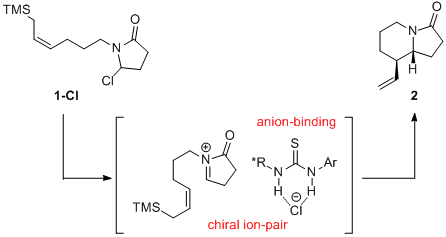
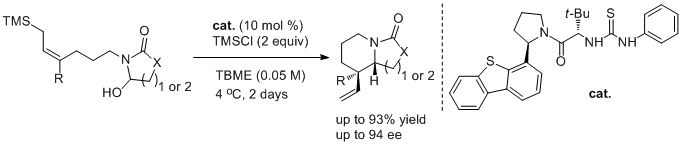
近期,Jacobsen小组发现手性硫脲能够促进氯代内酰胺1-Cl的离子化,从而产生手性离子对,进而发生对映选择性Aza-Sakurai环化反应,由此发展了一种高效的合成手性双环内酰胺2的方法。此方法可以合成多种多样的吲哚里西啶,喹诺里西啶以及相应双环骨架的化合物。这种催化剂的结构与对映选择性之间的关系以及对底物的研究趋向于一种从未报道过的硫脲催化机理,硫脲不仅参与了活性阳离子亲电试剂的产生,也作为路易斯碱活化烯丙基硅烷。作者认为,这种双活化策略在其他涉及相对弱的亲核试剂的转化实验中有很大的价值。(J. Am. Chem. Soc. 2016, 138, 14848−14851.)
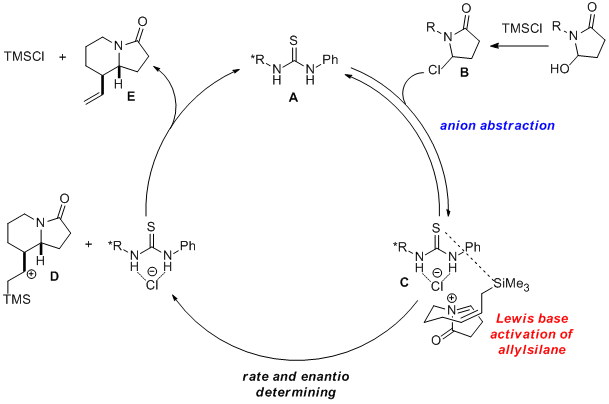
此反应的机理如下:首先,硫脲A诱导氯代内酰胺B离子化生成N-酰基亚胺正离子与硫脲络合的氯负离子生成手性离子对C。而且,阴离子的络合使硫脲的碱性得到了增强,进而活化烯丙基硅烷,从而进行环化反应得到D。最后,中间体D发生β-甲硅烷基阳离子消除得到最终产物E。