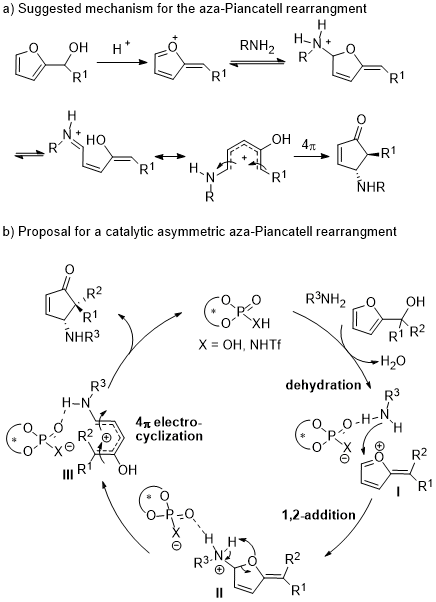
自1976年首次报道了Piancatell重排即酸催化2-呋喃甲醇衍生物转化为环戊烯酮的反应以来,该类反应被广泛地应用于许多天然产物和药物分子的合成。虽然过去几十年通过科学家的不断努力发展了一系列布朗斯特酸和路易斯酸实现了该类反应,但是到目前为止其不对称合成仍然是有机合成中极具有挑战性课题。主要有以下几个挑战:1)使羟基脱水的催化剂酸性要足够强;2)催化剂要能控制1,2-亲核加成的区域选择性;3)最关键的步骤是催化剂在4π电环化过程中必须要能诱导出对映选择性。因为使用胺作为亲核试剂时,5-位加成反应和重排反应存在竞争而导致其区域选择性的和对映选择性很难控制。
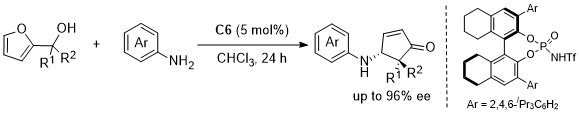
最近德国亚琛工业大学的Rueping教授通过以布朗斯特酸为催化剂实现了Aza-Piancatell的不对称重排反应。该催化体系反应条件温和,底物适用范围广,对映选择性好。同时该反应体系的实用性也较强,通过简单的几步转化就可以高效地合成HNK1抑制剂类似物。最后作者并对反应的可能机理进行了阐述。(
Angew. Chem. Int. Ed. 2016, 55, 14126 –14130) (MC).