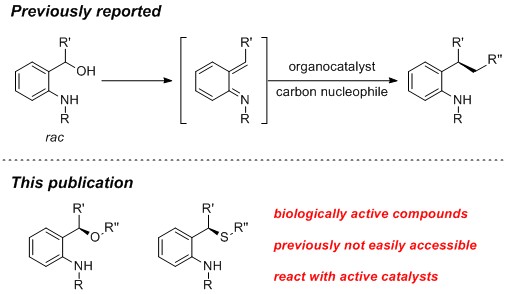
近年来,氮杂邻亚甲基醌中间体能方便构建四氢喹啉、吲哚以及更复杂的天然产物骨架,因此受到了有机合成研究者的广泛关注。然而,相对于邻亚甲基醌中间体,对氮杂邻亚甲基醌中间体的研究较少。邻氯甲基苯胺衍生物在碱性条件下1,4-消除,苄醇在加热条件下脱水以及邻羰基苯胺化合物在光催化条件下烯醇化是原位形成氮杂邻亚甲基醌中间体的常用方法。但是,高温、过量的碱以及连续光照的使用限制了底物范围,大多数反应也只有中等收率。易制备的二芳基甲醇在有机催化剂作用下脱水原位获得氮杂邻亚甲基醌中间体,再与亲核试剂反应形成新的碳碳键,条件温和,底物范围广,克服了以上常用方法的缺陷。最近,Rueping小组报道了手性布朗斯特酸催化下硫醇或醇对二芳基甲醇进行不对称取代反应制备手性硫醚或醚的新方法。
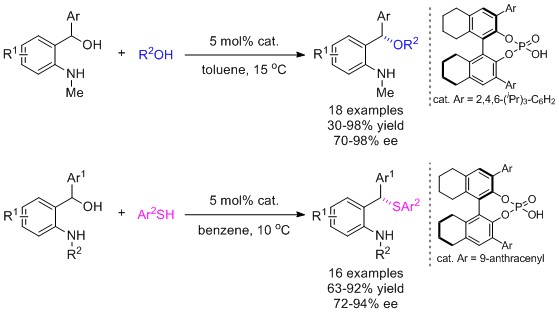
手性磷酸作为有机催化剂使得醇脱水具有较高催化活性,并且,保持适当酸性可以抑制产物的消旋化。该反应对不同的醇及硫醇均具有较好的普适性。值得注意的是,二级醇底物相对于一级醇底物获得的醚产物具有更高的对映选择性;而芳基硫酚底物相对于烷基硫醇底物的硫醚产物具有更好的活性和对映选择性。(Angew. Chem. Int. Ed. 2016, 55, 4803-4807.) (周吉 推荐)