钯催化烯基肟的碳醚化反应合成手性异噁唑啉
异噁唑啉结构广泛存在于天然产物、医药、材料以及农药中。具有手性结构的异噁唑啉在有机合成中可以转化为多种手性非环骨架,包括β-羟基酮、γ-氨基醇等。因此发展有效合成手性异噁唑啉的方法引起了化学工作者的极大兴趣。迄今为止,已经报道了以下两种方法: 1) 采用手性辅基诱导或手性路易斯酸催化肟的1,3-偶极环加成合成手性异噁唑啉。2) -使用铜/金鸡纳碱衍生的磺酰胺作为催化体系,通过烯基肟的对映选择性自由基氧三氟甲基化反应实现了手性含三氟甲基异噁唑啉的合成。
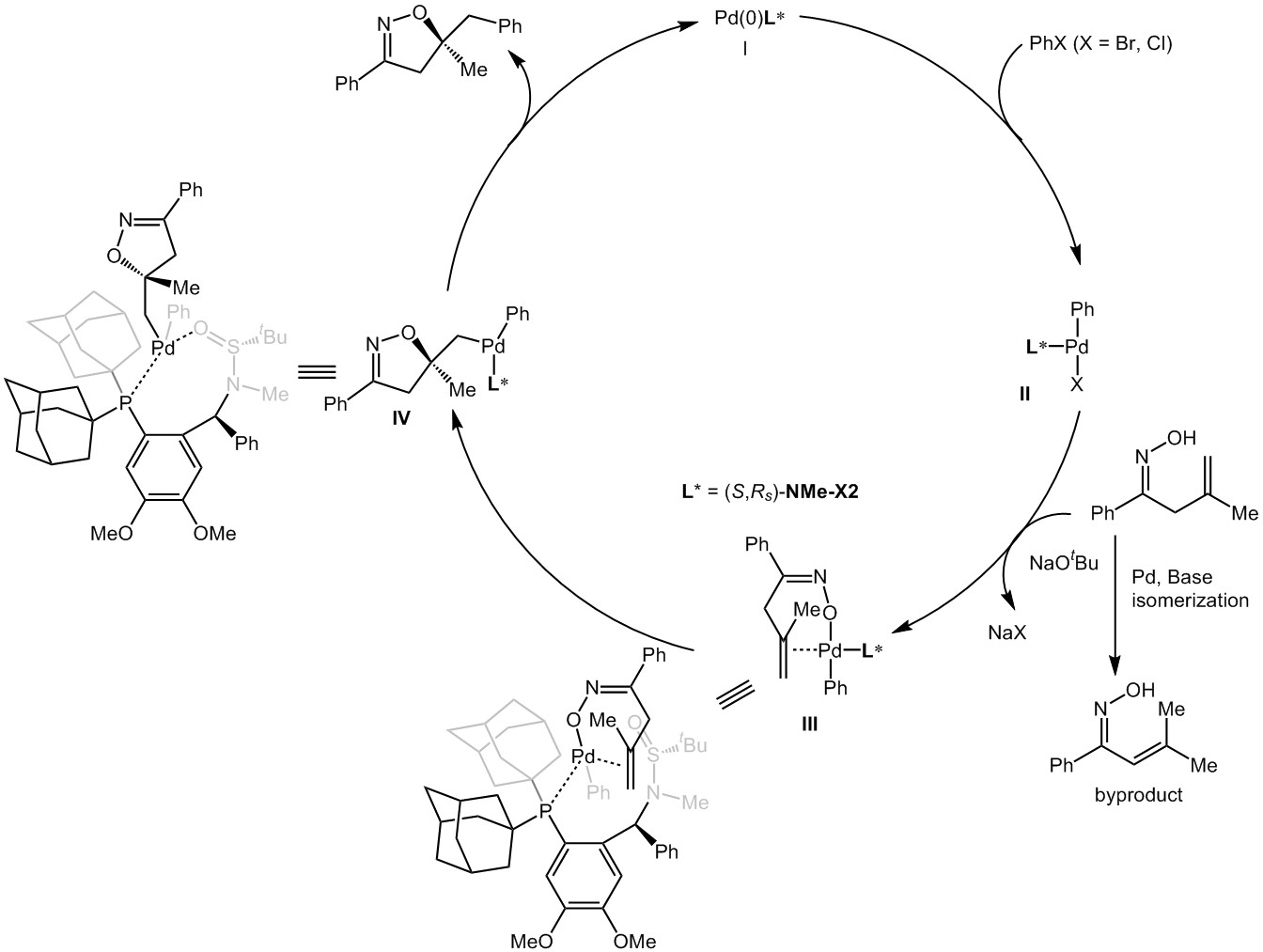
最近,张俊良小组使用Pd/Xiang-Phos作为催化剂,实现了烯基肟和芳基卤化物/烯基溴化物的碳醚化反应,高收率和高对映选择性地合成了手性3,5-双取代以及3,5,5-三取代异噁唑啉。在反应过程中作者发现,无N-H键具有N-甲基的大位阻亚磺酰胺磷配体参与的反应产物ee值较高。而且富电子的亚磺酰胺磷配体可以有效地促进烯基肟的碳醚化反应,减少原料异构化产物的生成。

基于先前的研究报道,作者提出可能的反应机理:首先芳基溴化物和金属钯发生氧化加成生成二价钯中间体II;接着在叔丁醇钠的条件下,中间体II和烯基肟发生配体交换生成中间体III;进一步进行烯烃插入生成中间体IV;紧接着中间体IV发生还原消除反应得到目标产物,再生零价钯完成催化循环。当芳基氯化物为原料时,由于其与金属钯氧化加成相对较慢导致底物异构化较严重,目标产物收率较低。(Angew. Chem. Int. Ed. 2020, 59, 4421)
(推荐人:赵洋 审查人:李翔)