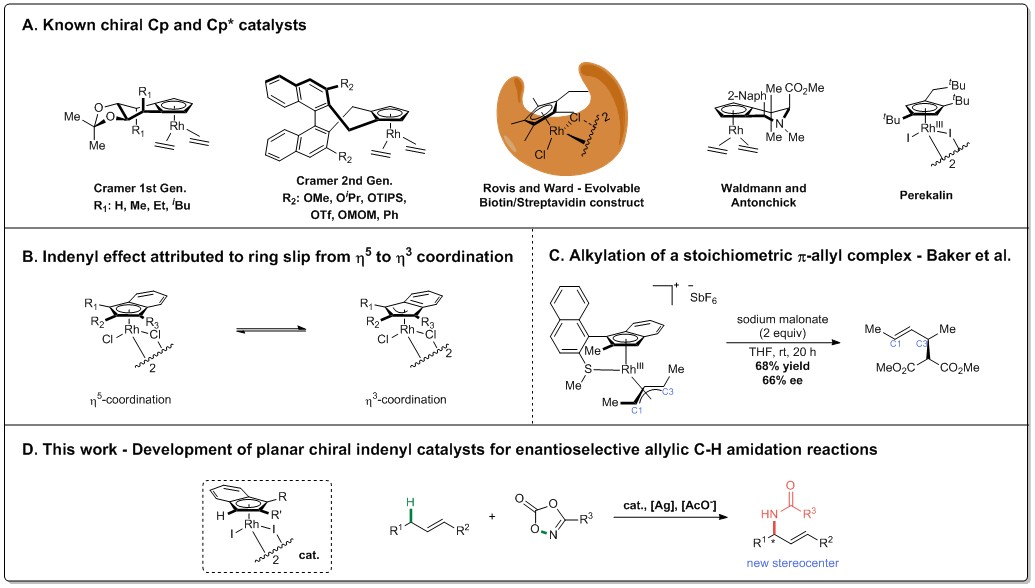
C-H键的直接和选择性官能化是有机合成中非常有用的策略。目前尽管取得了重大进展,但仍有许多挑战没有解决,特别是在C(sp3)-H键的立体选择性官能化方面。过渡金属催化在不对称C-H键官能化领域占据主导地位,这在很大程度上归因于优势配体类的设计和开发,以诱导对映选择性。环戊二烯基(Cp)配体已被很好地确立为此类优势配体结构中的一种,这一点已在过渡金属催化的C-H官能化中得到了广泛应用。钴,铑和铱的环戊二烯基(Cp)和五甲基环戊二烯基(Cp*)络合物已成为C-H定向官能化的极佳催化剂,因此,开发了一系列可变的优势手性配体。特别是,由Cramer课题组开发的配体已用于生成一系列过渡金属配合物,这些配合物在反应中均表现出优异的对映选择性。Rovis和Ward发展了一种可进化的工程化链霉亲和素与生物素化的Rh(III)Cp*对接,Waldman和Antonchick的氨基酸衍生配体和Perekalin的平面手性复合物(图1A)。这些开创性的方法激发了人们对合成手性Cp衍生物的兴趣,并将其应用于对映选择性C-H官能化。
与Cp结构相比,茚基(Ind)配体具有明显的反应性差异。最显着的是,茚基-金属络合物的η5和η3结合模式之间连续的茚基效应(图1B)可以显着加快反应速率。尽管已经彻底研究了表现出平面手性的前过渡金属(Ti,Zr)茚基配合物的化学性质,但在后过渡金属类似物的催化作用方面仍处于发展阶段。在第IX组金属配合物的背景下,Baker报道了茚基铑配合物与丙二酸钠的化学计量反应(图1C)。以中等的对映选择性(66% ee)获得烯丙基取代产物,并且由于电子不对称性,导致弱的Rh-C3键与对映体诱导保持一致。遗憾的是,在该体系中未观察到催化作用,并且所用配体的复杂性妨碍了系统性配体的发展。此外,硫醚官能团具有氧化作用,并限制了它在通过内球还原性C-N偶联机理进行转化的应用。基于此,作者报道了一类简单的茚基催化剂,这些催化剂的建立是为了利用平面手性茚基配合物中的电子不对称性进行不对称转化(图1D)。
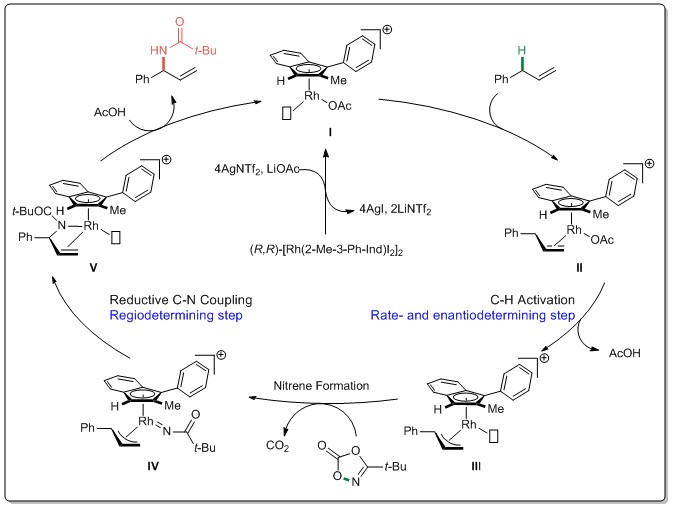
基于计算研究和实验观察以及先前报道的化学计量研究,作者提出了如下图所示的催化循环。首先,二聚催化剂(R,R)-[Rh]前体被AgNTf2和LiOAc活化形成配位不饱和阳离子茚基配合物I。随后进行烯烃配位,形成配合物II,接着进行决定速率和对选择性的C-H裂解过程形成π-烯丙基配合物III。紧接着二噁唑酮与π-烯丙基配合物III进行配位,释放CO2生成配合物IV,然后该配合物迅速进行区域决定性还原偶联,从而在π-烯丙基的支链位置形成烯丙基C-N键,得到配合物V,最后在乙酸的作用下,质子解脱金属生成目标化合物,同时再生活性催化剂I,完成催化循环。(J. Am. Chem. Soc. 2020, 142, 13996−14004) (推荐人:刘丽霞,检查人:李翔)