镍催化的有机硼酸酯与酮不对称芳基化
手性性叔醇是一类重要的结构单元,常见于药物、农药和具有生物活性的天然产物中(图1A)。此外,它们还可作为合成具有挑战性目标分子(含有季碳立体中心)的通用骨架。因此,探索构造手性叔醇的方法一直是化学界研究的热点。自格氏反应发现以来,有机金属试剂与酮的亲核加成被认为是合成非手性或手性叔醇最方便的方法,但仍然存在一些挑战(图1B)。首先,使用强碱和亲核的金属有机试剂,如有机镁、有机锌或有机铝试剂,会使反应对官能团的耐受性降低。此外,由于这些金属有机试剂对水和空气的敏感性,使得它们的制备和纯化过程复杂化。因此,这些方法通常不适用于高度官能化的化合物的直接转化或生物活性分子的后期官能化。
相比之下,有机硼亲核试剂的广泛可用性和稳定性赋予了Suzuki-Miyura偶联剂特殊的官能团容忍度和操作简单性,使其成为有机化学中最常用的反应之一。在此背景下,施世良课题组报道了Ni/NHC催化的芳基硼酸酯对简单酮的高区域和高对映选择性加成,提供了一种高效和便捷的途径来获得各种手性叔醇(图1C)。重要的是,该方案也适用于一系列高度官能化的药物或生物相关分子衍生的中间体。
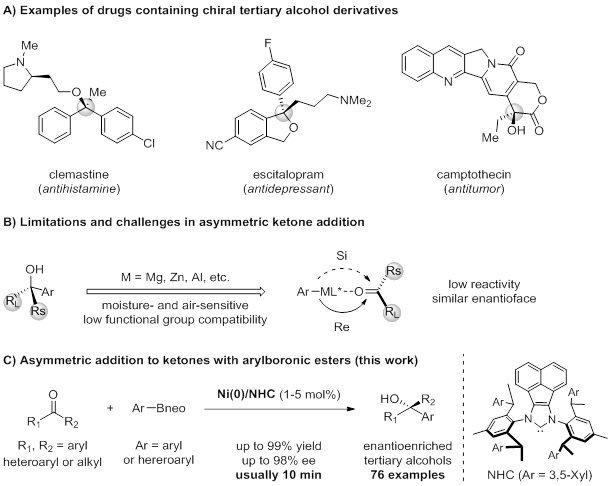
图1
作者提出如下反应机理:给电子的NHC螯合的Ni0物种促进了酮羰基的η2-活化和氧化环化作用,从而提供中间体I。随后甲醇钠促进转金属化,形成芳基-烷基镍络合物。接着还原消除,生成目标产物和再生Ni0催化剂,完成催化循环。(Angew. Chem. Int. Ed. 2021, DOI: 10.1002/anie.202015021.) (推荐人:黄文君) (检查:刘丽霞)
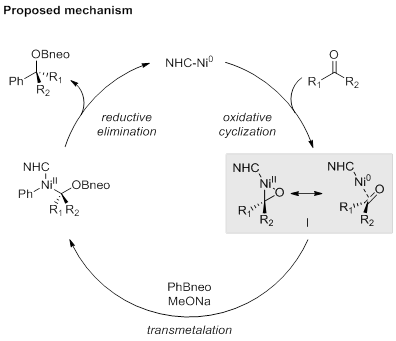
图2