在药物开发中已经认识到具有3D形状的有机化合物比芳香化合物更有可能成为候选药物。分子中sp3杂化碳原子的比例已被建议作为其3D形状的描述符。由于高通量合成已成为制药行业的标准做法,因此以平行方式引入sp3杂化碳原子的方法(例如烷基亲电试剂的交叉偶联)对于药物开发非常有价值。然而,烷基亲电试剂的对映选择性交叉偶联,尤其是烷基-烷基偶联,仍然具有挑战性。
不对称C(sp3)-C(sp3)偶联的一种策略是将金属氢化物加成到内烯烃中以形成手性金属烷基中间体,然后进行立体专一的烷基-烷基偶联。这种方法形成了一个立体中心,并补充了外消旋烷基亲电试剂的对映收敛烷基-烷基偶联,但其范围仍然受限。鉴于外消旋α-锌化的N-Boc-吡咯烷与烷基卤化物的偶联的报道,表明了这种烷基-烷基偶联方式的可行性,然而,挑战在于金属氢物种对内烯烃进行对映选择性加成以及与未活化的烷基亲电试剂偶联的能力。近年来,Cu-H催化的内烯烃对映选择性官能化发展迅速,但原位生成的手性有机铜中间体与未活化的烷基亲电试剂的偶联仍鲜有研究。与烷基亲电试剂偶联时,Ni-H催化比Cu-H催化更合适;然而,Ni-H插入内部烯烃时通常会进行“链行走”形成末端伯烷基镍中间体,从而使反应消旋。最近的研究表明α-芳基或α-硼烷导向基团可以稳定支链的有机镍中间体。但目前仅有一例报道,并且仅取得了较低的对映选择性(62% ee)。在此,瑞士洛桑联邦理工学院(EPFL)胡喜乐教授报道了利用简单易得、稳定的烯烃作为亲核试剂,未活化的烷基卤化物作为亲电试剂,在温和的条件下实现了Ni-H催化的不对称C(sp3)-C(sp3)交叉偶联。该反应可以取得中等及以上的收率,优秀的对映选择性(最高可以实现92%的对映选择性),具有底物范围广,官能团容忍性好等优点。
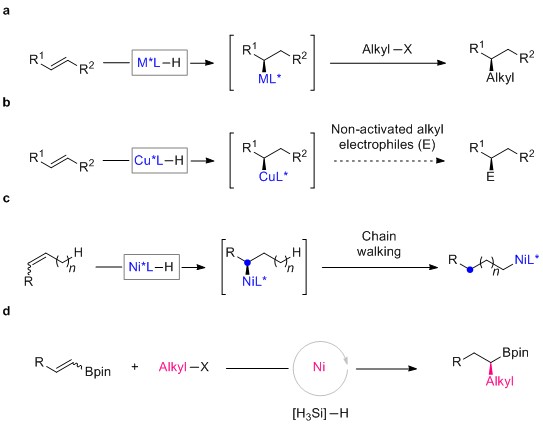
下图为作者提出的可能机理:在反应条件下,首先形成活性催化物种A,然后与烷基碘化物通过单电子转移过程形成烷基自由基和物种B,随后,物种B与硅烷反应生成Ni-H物种C,物种C区域选择性地插入到烯基硼烷中,生成手性的烷基中间体D,中间体D与烷基自由基结合生成高价的镍络合物E,最后通过还原消除得到目标产物和一价镍催化剂A,完成催化循环。(Nat. Chem. 2021, 13, 270–277.) (推荐人: 白雨晴, 检查人: 王晓清)
