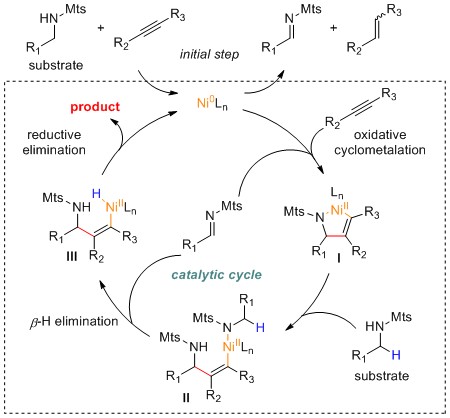
手性α-支链胺存在于许多农药和药物中,同时,它们也是不对称催化反应中重要的配体。过渡金属催化的C(sp3)-H键官能化反应可在氮邻位的sp3杂化碳中心引入取代基,是制备复杂胺的有效方法,因此受到研究人员的广泛关注。
在1980年代,报道了由前过渡金属催化胺与烯烃的α-烷基化反应,但是,这些金属的固有性质通常会限制苄基C-H键或伯C-H键的反应活性,同时官能团耐受范围狭窄,在大多数情况下,只有单取代的烯烃才能有效偶联。在后过渡金属催化中,偶联剂范围更广泛,可以使α金属化的中间体多样化,但该策略通常依赖于不易获得的导向助剂,具有局限性,特别是在考虑大规模合成和步骤/原子经济性时,此外,除极少数情况外,对绝对立体化学的控制仍然难以实现。与上述涉及C-H键金属化的方法不同,氧化剂或光氧化还原催化剂,可以实现胺的α-C-H键官能团化,但胺类范围和不对称催化版本,仍有待扩展。
近期,西湖大学石航课题组报道了镍催化由简单磺酰基保护的伯胺的α-烯基化反应。在手性膦配体作用下,可取得很高的对映选择性。而且,产物具有易于转化的烯丙基结构,通过对双键的官能团化可以得到结构各异的高附加值胺类衍生物。
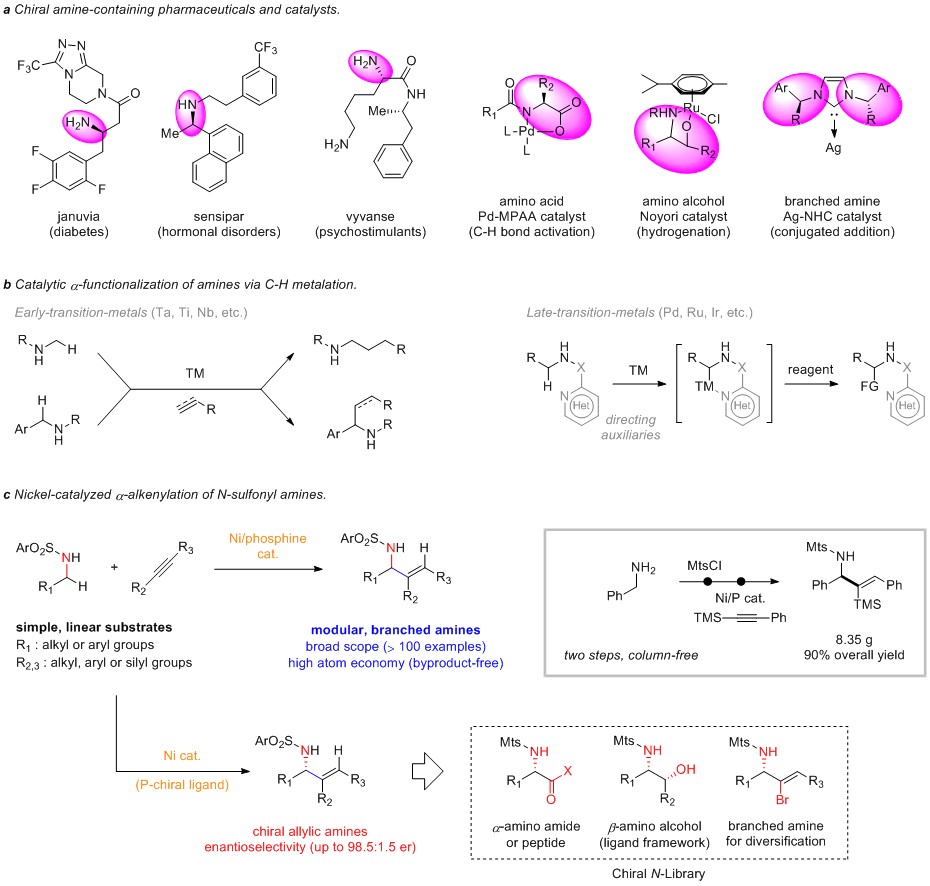
作者根据机理实验和先前报道基础上,提出如下反应机理。首先Ni(0)对N-H键发生氧化加成,随后经β-H消除产生催化量的亚胺并释放Ni(0)物种;该亚胺经由氧化环金属化生成中间体I启动催化循环;随后发生配体交换生成烯基镍中间体II;最后通过β-H消除与还原消除生成目标产物,完成催化循环。(J. Am. Chem. Soc. 2021, 143, 4154-4161.)(推荐人:王坤,检查人:白雨晴)