在构建苄位手性季碳的方法中,一种简洁且原子经济性高的方式是通过手性酸质子化1,1-二取代烯烃,形成三级碳正离子,随后经不对称抗衡离子导向的傅克芳基化来构建手性季碳。然而,这类转化至今没有实现。虽然非活化烯烃的催化氢芳基化反应具有百万吨级的实际应用价值,但是这类反应的不对称版本仍旧处于发展初期。在之前的报道中,有机小分子催化剂可以实现活化烯烃及芳烃的不对称芳基化反应,金属催化剂实现不对称芳基化则大多依赖于共价结合的导向基团的作用。在最近几年的报道中,Widenhoefer、Peters和Cramer课题组分别实现了Pt或Ni催化的吲哚化合物的不对称芳基化,Hartwig和Meek课题组也分别报道了Ir和Rh催化的分子间不对称芳基化反应,但反应底物局限于降冰片烯和1-芳基丁二烯。
迄今为止,利用非活化烯烃的氢芳基化过程实现手性季碳的构建仍旧是一个具有挑战性的课题。德国马克斯·普朗克煤炭研究所的Benjamin List课题组最近报道了亚氨基二膦酰亚胺(IDPi)催化的非活化烯烃的马氏氢烷氧基化反应。该发现表明,这种独特的活化模式也适用于通过碳正离子中间体进行的其他转化。在这些研究的基础上,该课题组最近报道了非活化烯烃与吲哚的不对称分子内氢芳基化反应,可以高对映选择性构建具有苄位季碳立体中心的四氢咔唑。

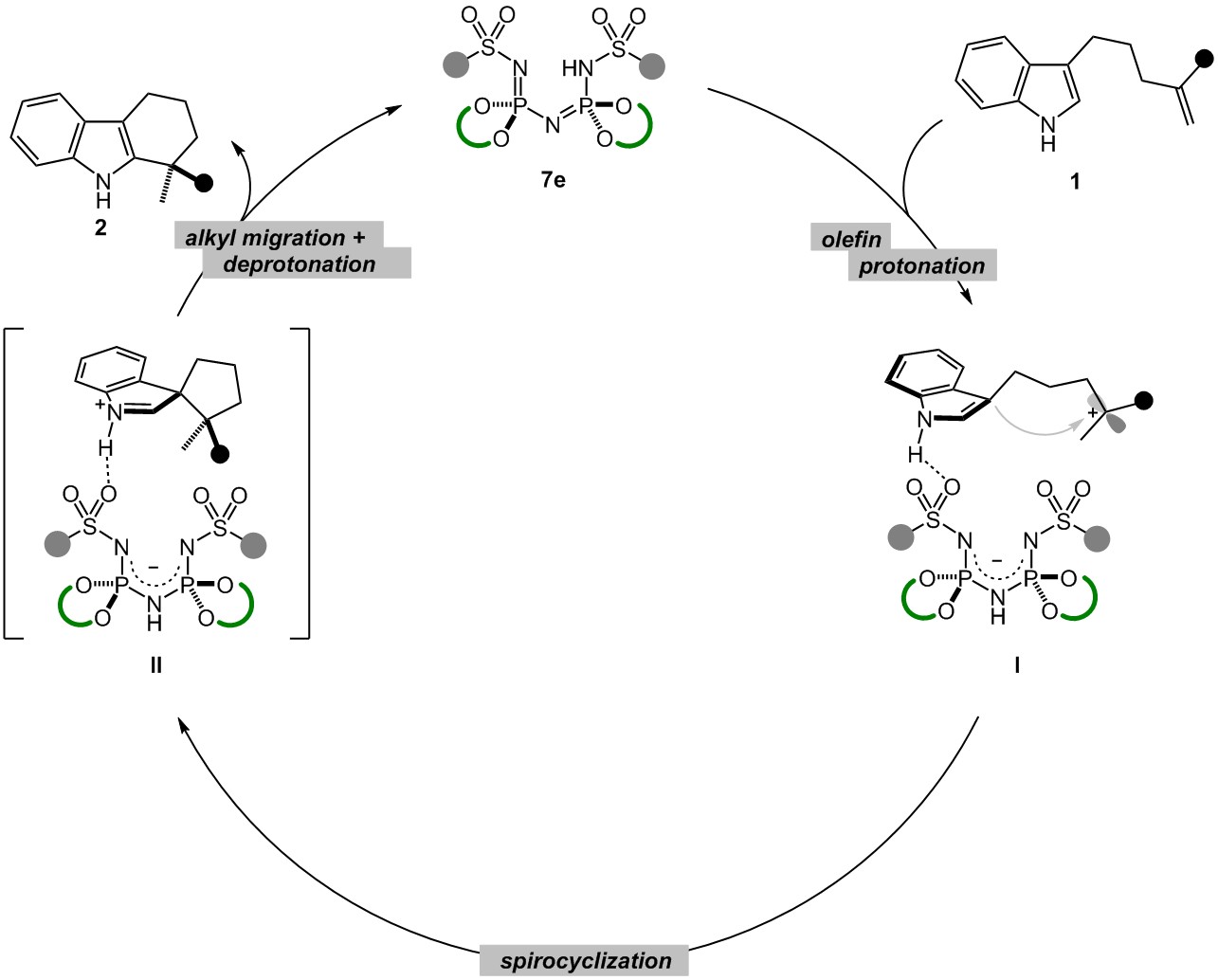
通过机理研究实验,作者认为反应经过了六元螺环中间体,并提出了相应的反应机理:首先底物在酸性催化剂作用下实现质子化,生成离子对中间体I;随后在手性抗衡离子的导向下吲哚对碳正离子进行亲核进攻生成螺环中间体;最后经烷基迁移、质子转移过程生成最终产物并再生催化剂7e,完成催化循环。(DOI: 10.1021/jacs.0c12042.)(推荐人:高璇宇,检查人:白雨晴)