过去的几十年里,通过张力环释放进行的转化策略广泛被应用于有机合成化学、材料科学以及生物共轭领域中。因此,介于相反的碳或氮原子之间带有桥键的分子,例如:[1.1.1]推进烷、双环[1.1.0]丁烷(BCBs)或1-氮杂双环[1.1.0]丁烷已成为一类特殊的化合物。它们结构相对不稳定的原因,是由于键长和键角扭曲、扭转张力、非键以及跨环空间相互作用引起,这些“受载弹簧”化合物对亲核试剂、亲电试剂和自由基显示出具有π键的行为。这种有用的反应类型在用于制备药物化学双环[1.1.1]戊烷、环丁烷和氮杂环丁烷的部分,发育和发育过程中作为生物等排体的基序和药物的修饰等领域特别需要。
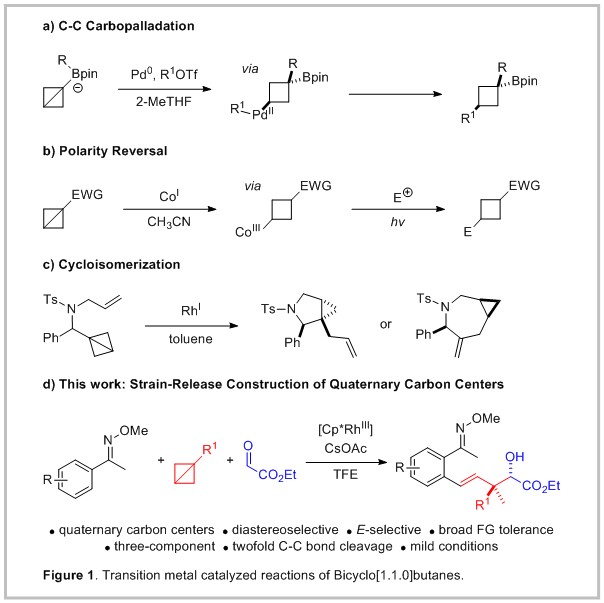
基于Baran’s等人采用张力环释放策略构建C−N的基础工作,化学家们对这些分子的独特性质有了重新的认知。2019年Aggarwal小组扩充了BCB化学工具箱。以BCB硼酸盐复合物为原料,由1,2-金属酸盐触发的重排,使得中心 C-C σ-键的碳钯化以及随后进行的交叉偶联反应,从而获得更有价值的双官能化环丁基硼酸酯。为了克服BCBs固有缺电性的亲电子反应性,Gryko及其同事报道了正式的极性反转方法。一价钴催化经过三价钴烷基中间体并在光诱导下均裂能够产生亲核自由基。这些自由基可以与亲电试剂偶联,得到二取代的环丁烷。除了这些鼓舞人心的实例之外,涉及BCBs的过渡金属催化转化仍然稀缺。Wipf及其同事指出了在BCBs反应的各种机理途径中,过渡金属催化或许也可以被应用。他们表明含氮拴系BCBs可以通过一价铑催化,经过连续的环丙异构化-环丙烷化过程,形成吡咯烷和氮杂环庚烷类化合物。因此,非常希望新的金属催化方法的发展和BCBs其它反应途径的探索。为了拓展已知反应性文库,我们设想了有机金属物种与BCBs反应,并将C-H活化作为合适的策略,因为它能够从普遍存在的C-H键出发,在温和的条件下产生这些中间体,这些中间体能够与多种不同的耦合试剂反应。在这样的文献背景下,特别是最近被报道的多组分反应具有在单一步骤中构建复杂分子结构的潜力,这也说明了有机合成具有非常大的吸引力。基于此,作者以肟醚和乙醛酸乙酯为原料,三价铑作为催化剂,在碱性条件下与双环[1.1.0]丁烷反应,通过张力环的释放,成功实现了多组分反应,构建了一系列含有全碳立体中心的化合物,产率最高达81%,非对映选择性大于20:1。
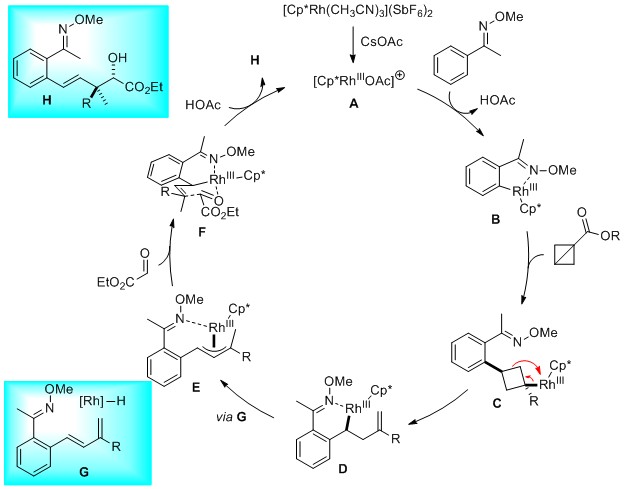
最后,作者提出了可能的反应机理:首先铑催化剂在碱性条件下生成活性物种A,进一步进行碳氢键活化,生成芳基铑中间体B,接着与双环[1.1.0]丁烷衍生物反应生成烷基铑中间体C,随后经过β-碳消除生成中间体D,中间体D经过顺式-β-氢消除和再插入得到烯丙基铑中间体E,紧接着与乙醛酸乙酯反应和在酸性条件下质子脱金属得到产物再生活性物种A,完成催化循环。(J. Am. Chem. Soc. 2021, 143, 7648) (推荐人:李翔 检查人:赵洋)