饱和C-C键普遍存在于有机分子中,发展饱和C-C键的立体选择性构建策略对于分子合成及逆合成分析有着重大的影响。有研究表明,增加候选药物分子手性碳中心的数量将有助于提高其临床试验成功率。然而,开发强有力的策略来对映选择性地构建饱和C-C键仍是目前所面临的挑战。
通过引入辅助基团进行外消旋原料的自由基偶联或不饱和双键金属氢化物迁移插入均可获得手性产物。这些辅助基团在控制反应对映选择性的同时,也限制了底物的适用范围。最近,傅尧小组发展了钴氢催化体系用于实现高区域和高对映选择性的烯烃氢烷基化反应。在这个温和的催化体系下,可以成功地实现不含辅助基团底物的对映选择性C(sp3)-C(sp3)偶联。此外,利用非手性含氟烯烃和烷基卤化物,可以在烷基链上的所需位置快速引入脂肪族C-F立体手性中心。
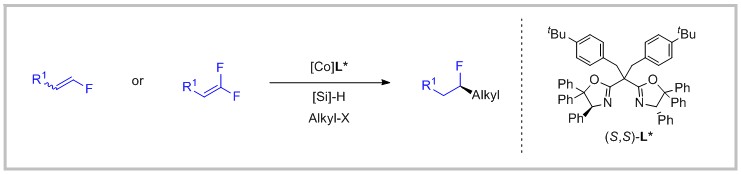
结果显示该条件有着较好的官能团容忍性,对于烷基卤化物适用范围广,产率和对映选择性高。该反应还可以用于药物分子和天然产物的后期修饰,研究人员还考察了单氟烯烃的适用范围,各种单氟烯烃同样取得满意的效果。
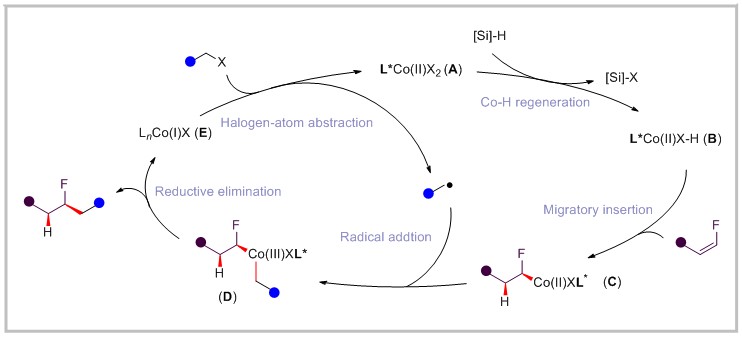
该反应的可能机理如下,二价钴在[Si]-H物种的存在下首先生成Co-H物种B,随后物种B插入到C=C双键中形成中间体C,烷基自由基与中间体C进行自由基加成后得到中间体D,中间体D经还原消除得到目标产物并生成一价钴,一价钴与烷基卤化物经单电子转移再生二价钴,完成催化循环。氢金属化是反应的决速步和对映选择性控制步骤。
Reference: Li, Y.; Nie, W.; Chang, Z.; Wang, J.-W.; Lu, X.; Fu, Y. Cobalt-Catalysed Enantioselective C(sp3)-C(sp3) Coupling. Nat. Catal. 2021, 4, 901.(推荐人:荀珊珊,检查人:白雨晴)