α-氨基酸作为蛋白质及多种天然分子的重要组成部分,在生命体中扮演着至关重要的角色。在工业界和学术界,非天然氨基酸常被应用于调节化学、物理和药物性能。目前合成α-氨基酸主要方法是通过直接不对称Csp3-H胺化。该类方法使用的底物一般为能够形成烯醇中间体的醛、酮或二羰基化合物,然后形成的烯醇中间体再与重氮化合物反应生成胺化产物。虽然这类方法已经取得了长足的进展,但是更加廉价易得的羧酸衍生物作为原料还没有被报道,并且重氮化合物的使用导致胺化产物不易于向α-氨基酸转化,限制了底物的适用范围。
本文报道了一种立体控制的1,3-氮迁移快速构建手性α-氨基酸,具有较好的经济实用性。该方法使用丰富且易于获取的羧酸作为起始材料,首先与固氮试剂反应得到氮杂酯底物,进一步通过手性钌配合物或铁配合物催化的Csp3-H胺化得到手性α-氨基酸。这种方法具有广泛的底物适用性,特别是对于合成具有芳基、烯丙基、炔丙基和烷基侧链的手性α-氨基酸提供了便捷的方法。
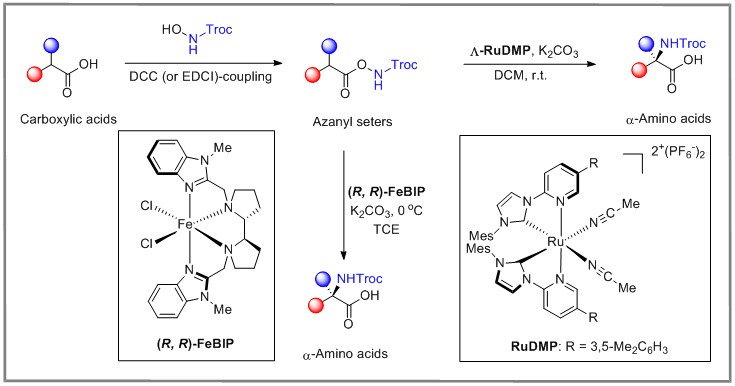
作者通过实验研究和DFT计算,提出如下可能的反应机理:氮杂酯底物首先经过N-O键活化发生裂解和去质子化得到中间体A,随后通过立体选择性控制氢原子转移得到双自由基B,接着快速的自由基回弹得到螯合物C,进一步发生羧酸盐的质子化得到目标产物和再生催化剂,完成催化循环。N-O键断裂和随后逐步的C-H插入,其净结果是不对称的1,3-氮迁移,从而生成手性α-氨基酸。
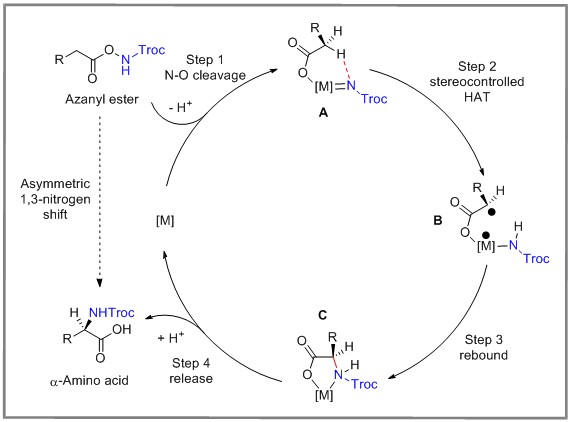
Reference:Ye, C.-X.;Shen, X.;Chen,S.; Meggers, E.*Stereocontrolled 1,3-Nitrogen Migration to Access Chiral α-Amino Acids. Nat. Chem. 2022, DOI: 10.1038/s41557-022-00895-3.(推荐人:王高伟 检查人:李翔)