环丁烷是生物活性分子和天然产物中的重要结构单元,然而,关于环丁烷的对映选择性制备还未得到广泛研究。α,β-不饱和酮的1,4-加成是对映选择性形成C-C键研究最为广泛的策略之一。虽然多种线性和环状底物可以进行金属催化的不对称共轭加成,但环丁烯酮却是一个例外。这是由于环丁烯酮自身很不稳定,即使在低温下它也会迅速聚合,而且通过简单的1,4-加成-质子化过程生成的酮通常是非手性的。
近期,牛津大学Fletcher课题组报道了铑催化芳基或烯基硼酸与环丁烯缩酮的不对称芳基化反应,该反应使用手性二烯配体能够在室温下迅速进行,此外对反应产物进一步修饰可获得结构多样的环丁烷。该反应有效地替代了铑催化环丁烯酮的1,4-加成。
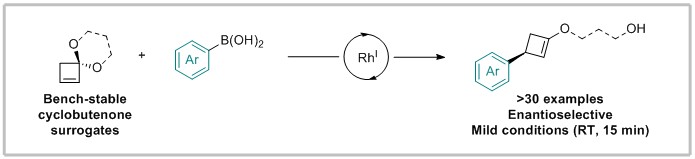
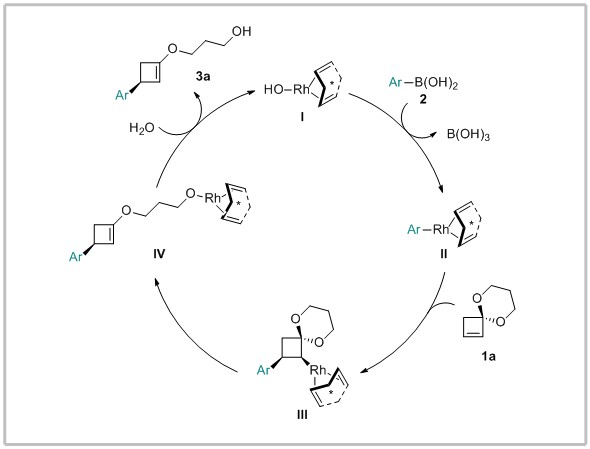
作者提出该反应的可能机理如下:铑络合物I与硼酸2经转金属化得到中间体II,随后环丁烯缩酮1a的碳碳双键插入到中间体II的Rh-C键中得到中间体III,作者推测该步的区域选择性可能不受缩酮的导向因素控制,而是完全由空间控制的。中间体III经过β-O消除使得缩酮开环得到中间体IV,最后中间体IV经水解得到产物3a并再生催化剂I,完成催化循环。
Reference: Egea-Arrebola, D.; Goetzke, F. W.; Fletcher, S. P.* Rhodium-Catalyzed Asymmetric Arylation of Cyclobutenone Ketals. Angew. Chem. Int. Ed. 2023, 62, e202217381.(推荐人:白雨晴;检查人:刘正)