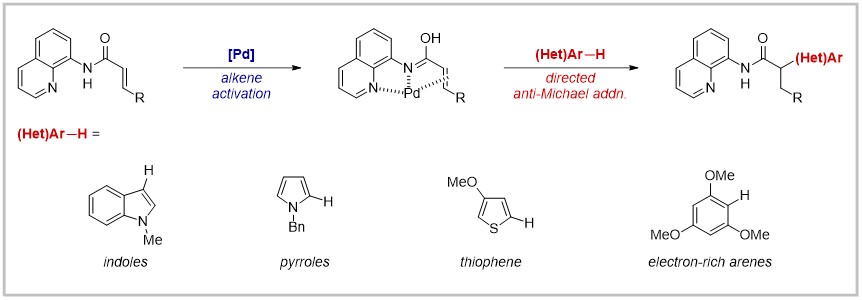
1887年,Arthur Michael报道了经典的Michael加成反应,以α,β-不饱和羰基化合物作为π受体,在β位形成新的碳-碳键或碳杂键。与此形成鲜明对比的是,反Michael加成,即在α,β-不饱和羰基化合物的α位发生加成的反应并不常见。相较于羰基的α位,羰基β位具有更强的亲电性,这使得在α,β-不饱和羰基化合物的α位发生加成较为不利。利用过渡金属催化的α,β-不饱和羰基化合物的α氢芳基化反应虽有报道,但也存在一定的局限性。因此,开发更具普适性的分子间α位选择性Michael加成反应具有非常重要的意义。
近期,日本东京理科大学的Takanori Matsuda课题组和日本福井大学的Hirotsugu Suzuki合作,利用钯对碳碳双键的配位,改变α,β-不饱和羰基化合物的电子分布,从而活化碳碳双键以扭转选择性,成功实现了分子间α位选择性Michael加成芳基化反应。
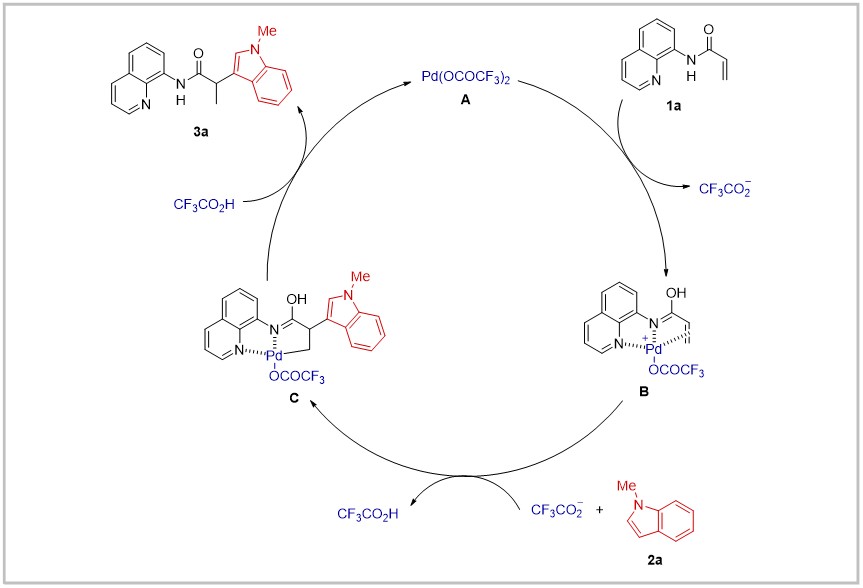
作者提出了可能的反应机理。首先,三氟醋酸钯受底物1a中氨基喹啉结构的导向作用,对α,β-不饱和羰基化合物中的双键进行活化,形成钯络合物B。随后2a对中间体B中羰基的α位亲核加成,形成较为稳定的五元环钯物种C,最后,三氟醋酸对C进行质子化,得到目标产物3a,并再生三氟醋酸钯完成催化循环。
Reference: Suzuki, H.; Moro, R.; Matsuda, T. Palladium-Catalyzed anti-Michael-Type (Hetero)arylation of Acrylamides. J. Am. Chem. Soc. 2024, 146, 13697. (推荐人:陈浩东,检查人:于燕江)