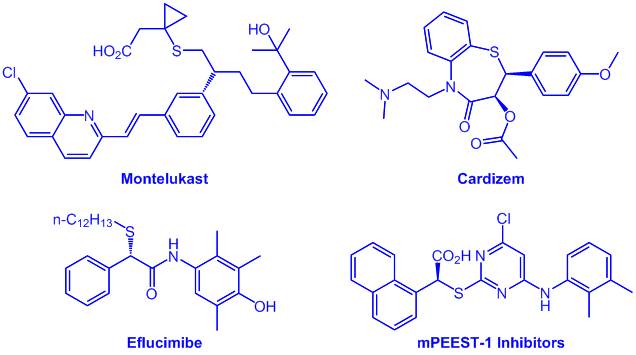
碳硫键广泛存在于生物活性分子以及药物中,包括β-内酰胺、磺胺类抗生素、青霉胺和免疫缀合物等。作为一种含硫化合物,苄基硫醚具有多样的生物活性,是许多药物和天然产物的结构单元。例如,孟鲁司特,地尔硫卓,以及mPGES-1抑制剂,这些药物和天然产物中的手性中心上都有碳硫键。
目前,合成手性苄基含硫化合物的方法较少。主要是通过以下几种途径来实现的:(1) Lewis酸催化的手性苄醇的SN2取代反应;(2) 铱/钯催化硫醚的不对称烯丙基化反应;(3) 磺酰基吲哚的不对称巯基化反应;(4) 铑催化三氟甲基巯基化反应;(5) 手性苄胺的亲核取代反应。其中,方法1的产物ee值一般较低(8-15%);方法2需要使用贵金属及手性配体;方法3和4的底物范围较窄。方法5的手性转移效果较好,底物范围也相对较宽,但产物的收率中等。最近,曾庆乐小组使用铜催化体系实现苄基叔胺的碳硫键偶联反应。该反应通过三氟甲磺酸甲酯原位活化手性胺底物,接着与硫醇或硫酚发生亲核取代反应实现苄基硫醚的高对映选择性以及高收率的合成。
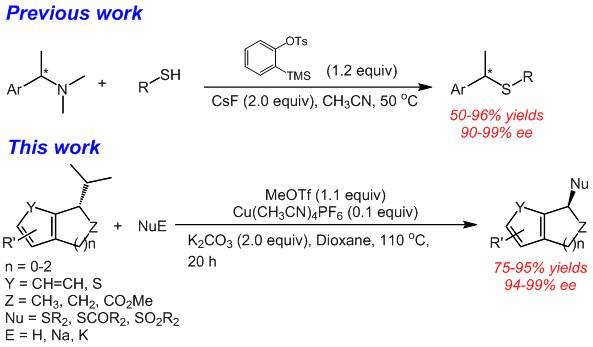
通过对铜催化剂、碱、溶剂以及等因素的筛选,确定反应的最优条件为:Cu(CH3CN)4PF6 (10 mol%),K2CO3 (2.0 equiv),MeOTf (1.1 equiv)。该方法能够实现25个底物的碳硫键偶联反应。反应能以最高95%的分离收率,99%的ee值得到产物。
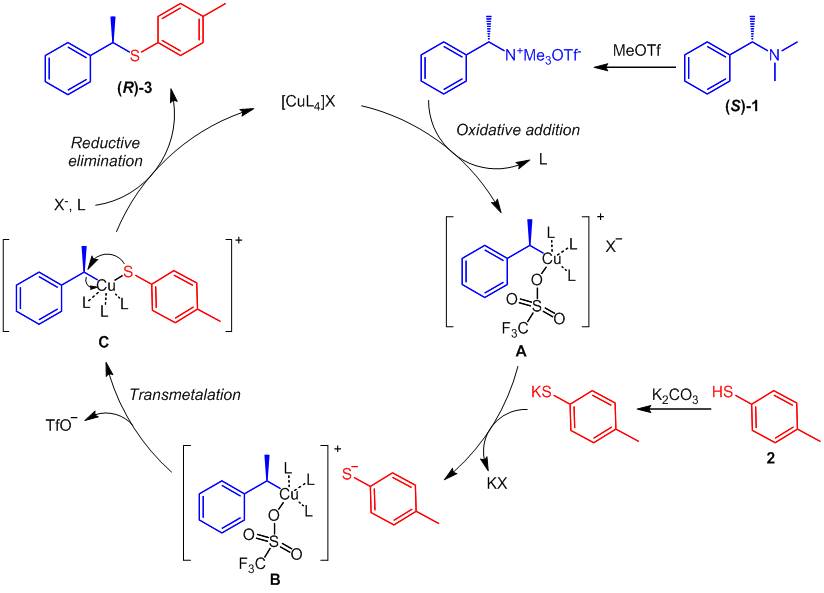
结合之前的研究和本文中的机理实验结果,作者提出了如下可能的反应机理:首先手性胺与三氟甲磺酸甲酯快速反应生成季铵盐,接着与铜催化剂发生氧化加成得到中间体A;另一个方面,对甲苯硫酚与碳酸钾反应得到硫酚钾盐;随后中间体A的六氟磷酸根离子会与硫酚负离子发生交换得到中间体B;然后中间体B发生分子内的转金属化得到中间体C,最后,中间体C发生还原消除得到产物3,并再生一价铜催化剂。(ACS Catal. 2018, 8, 9899.)
推荐人:翟小勇