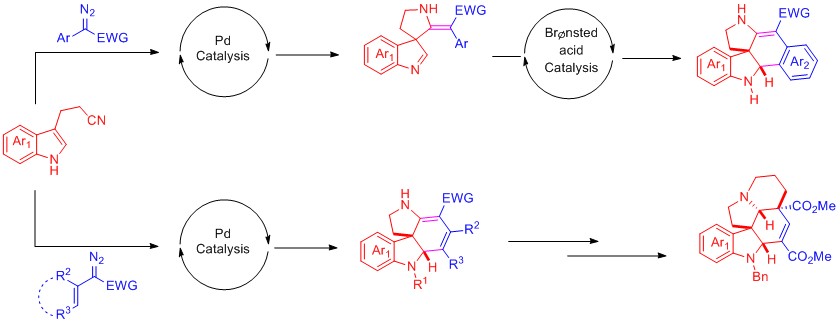
含有吲哚啉骨架的化合物广泛存在于天然产物及生物活性分子中,并且含有此类骨架的药物分子普遍具有抗肿瘤、抗癌等多种生物活性,目前不少已经发展成为临床上常用的抗癌药物。由于其结构易修饰且具有广泛的应用价值,因此备受化学家们的青睐。近年来,化学家们通过不断地探索,发展了一系列构建吲哚啉骨架的合成方法;但是,这些方法大都集中于利用复杂底物的分子内反应,而通过简单的底物进行分子间反应来高效的合成该骨架的例子还很少,尤其在这一过程中利用手性催化剂实现多个手性中心的有效控制是一个巨大的挑战。最近,广州大学的刘运林课题组报道了这样的一例利用钯和手性磷酸接力催化的高效、高立体选择性构建具有多样性结构的多环螺吲哚啉化合物的反应。该小组利用3-(2-异氰乙基)吲哚和重氮化合物通过交叉偶联可以合成含有两个连续手性中心的多环螺吲哚啉骨架;之后在以手性磷酸为催化剂,可以实现多环螺吲哚啉的不对称合成。利用此方法,该小组通过简单的化学转化丰富了3-(2-异氰乙基)吲哚的反应模式,为多环螺吲哚啉的合成提供了新路径,产物有望在药物研发中得到应用。
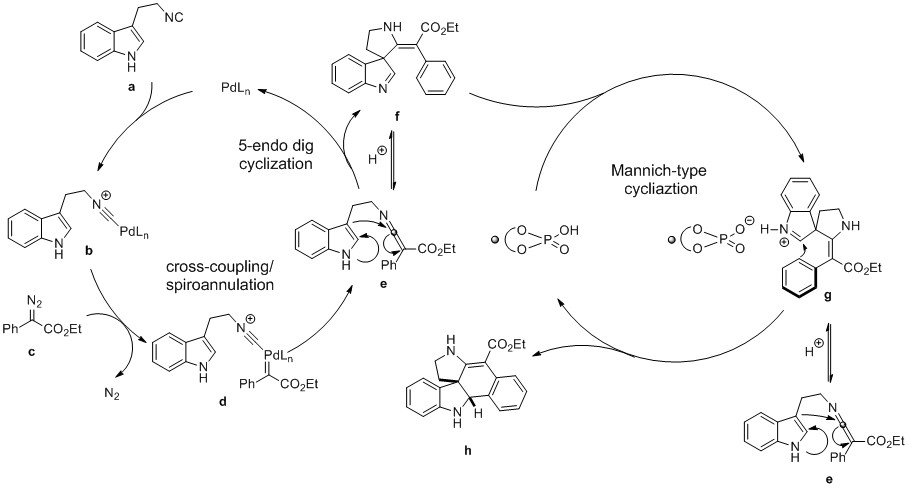
最后,作者通过实验研究提出了可能的反应机理。首先,3-(2-异氰乙基)吲哚a与PdLn形成中间体b;之后与重氮乙酸酯c反应生成钯卡宾中间体d,释放N2;随后,将异氰化物迁移插入钯卡宾,接着进行还原消除,得到高度亲电的吲哚衍生的酮亚胺中间体e;之后,吲哚C3位置亲核进攻生成螺环吲哚f。而f可以通过手性磷酸催化的曼尼希型环化反应将其转变为五环螺环吲哚h。在该转化中,作者推测f可以在酸催化剂存在下通过开环快速形成酮亚胺中间体e,进而能够形成具有良好对映选择性的目标产物h。(DOI: 10.1002/anie.201911614) (推荐人:胡子琦) (检查:李翔)