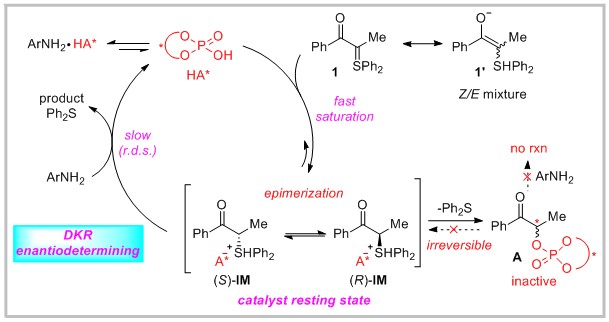
手性α-氨基酮是重要的结构单元,广泛存在于药物分子中。鉴于其可以作为合成手性β-胺基醇的前体,而后者常被用作手性配体。因此,在不对称合成领域,该手性分子的合成一直受到有机化学家的关注。在过去的几十年,相关文献已经报道许多。其中,最直接的方法是酮烯酸酯的直接亲电α-氨基化。该方法主要问题在于:1) 底物受限于环状酮或活化酮;2) 仅用于四取代手性α-氨基酮的构建;3) 考虑到与催化体系的兼容性,仅能用掩盖或受保护的胺作为氮源,例如:重氮羧酸盐、叠氮化物和酰胺。近来,虽然通过使用其它策略合成该手性分子已经取得了一些进展,但催化不对称合成非环α-叔氨基酮仍然是挑战。针对这些问题,作者介绍一个完全不同的方法来应对这些挑战。α-羰基硫叶立德是非常有用的有机合成子,常用作α-重氮羰基的替代物。目前,该分子主要应用于环加成反应当中,对于氢杂原子插入反应的研究相对较少。最早追溯到Müller报道的铑催化的分子内碳氢键插入以及Burtoloso报道的通过手性硫脲催化的硫氢键插入,但其底物仅限于α-酯基硫叶立德,而对于α-羰基硫叶立德的反应研究并未实现。另外,α-羰基硫叶立德相对于重氮酮具有不易分解和相对稳定的优点,因而是一个理想的底物选择。在这样的文献背景下,作者以α-羰基硫叶立德为底物,使用手性磷酸作为催化剂,经过动态动力学拆分过程,与芳胺反应成功实现了手性α-叔胺基酮的合成。
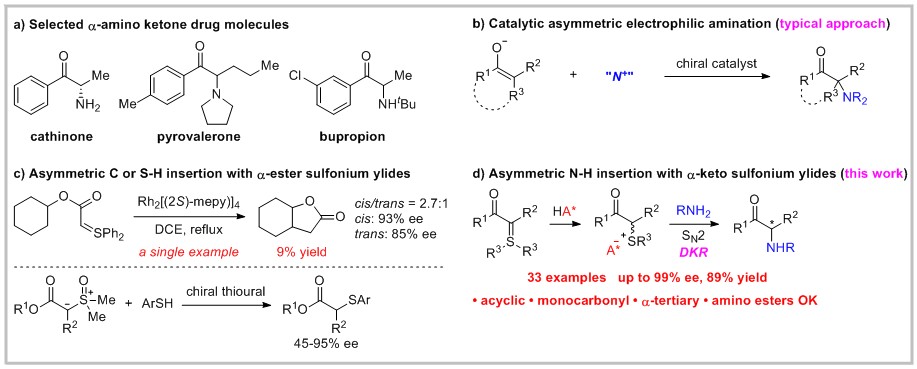
作者通过实验证明,提出可能的反应机理:首先,底物在手性磷酸的催化下,生成手性离子对(S)-IM和(R)-IM (催化剂静止状态),两个中间体之间可以快速异构化,然后其中一种构型中间体(手性匹配)和芳胺反应得到目标产物。(J. Am. Chem. Soc. 2020, 142, 14384-14390.)(推荐人:李翔 审查人:赵洋)