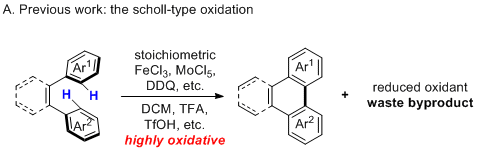
脱氢环化反应(也称为Scholl-type反应)在各种生物活性或功能分子的合成中具有广泛的用途。特别地,涉及邻三芳基的芳构化反应已经成为制备聚芳烃PAHs中越来越重要的方法。虽然广泛使用,但Scholl氧化通常需要过量的强酸或强氧化剂,因此导致许多无用的副产物。另外,许多官能团容忍性较差,并且在这种条件下经常观察到副反应,例如1,2-芳基转移,过氧化和底物分解。关于底物的范围,Scholl氧化反应通常更喜欢电子中性或中等电子富集的芳烃。相反,缺电子的芳烃或高度富电子的杂环是难以反应的。尽管通过其他方法包括在非均相催化剂,电化学条件或光化学条件下也可以实现邻三芳基化合物的相同类型的脱氢环化,但仍需要使用化学计量的强酸或氧化剂。另一方面,也可以通过相关的氧化还原中性的方法例如钯催化的交叉偶联和消除光环化来获得苯并菲产物,尽管这需要使用更多的官能化底物。因此,实现邻三芳基的有效的,通用的,温和的和原子经济的脱氢环化反应将是非常有吸引力的。
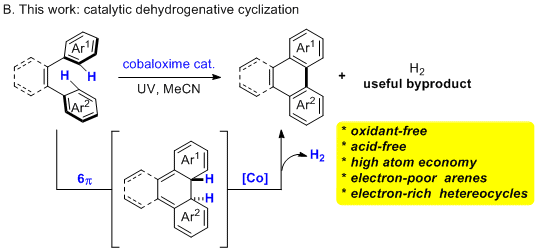
在许多氢原子转移(HAT)和水分解型析氢反应中,钴肟已被报道为通用的催化剂。特别地,最近光氧化还原催化与钴肟HAT催化的结合导致了许多新的析氢转化。然而,其在简单的芳烃底物的脱氢环化中的应用仍然很少且受到限制。另一方面,钴肟催化析氢的有机光化学过程的直接偶联反应例如电环化(在没有光氧化还原催化剂的情况下)尚未报道。鉴于氢气是有用的副产物,以及对更多的化学选择性PAH合成的需求,作者开发了在无酸和无氧化剂条件下钴肟催化的杂芳基无受体脱氢环化反应。
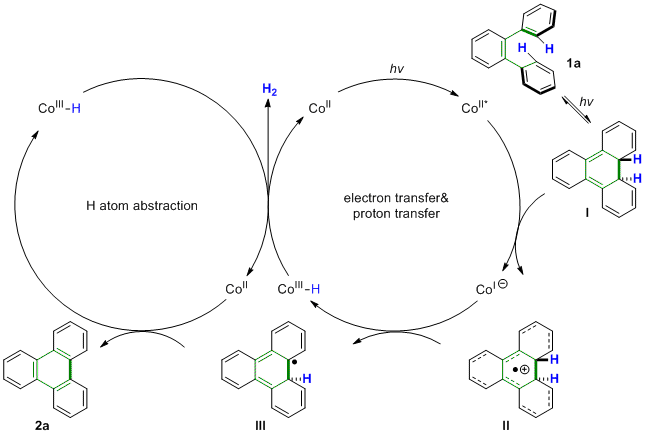
作者提出了提出一种钴催化脱氢环化的机理:反应从光激发的顺旋6π电环化反应开始,以生成瞬态反式二氢-苯并菲中间体(I)。同时,光激发的CoII催化剂接受来自中间体(I)的电子以产生高度离域的自由基阳离子中间体(II),并且所得的阴离子CoI将从II中提取质子生成CoIII氢物种和中间体III。随后,CoIII氢物种经历钴氢键的均裂,从而释放出H2并且再生CoII催化剂。CoII催化剂从中间体III中攫氢,从而得到产物2a和CoIII氢物种。(Angew. Chem. Int. Ed. 2020, 59, 15249 –15253) (推荐人:朱周豪,检查人:丁艺璇)