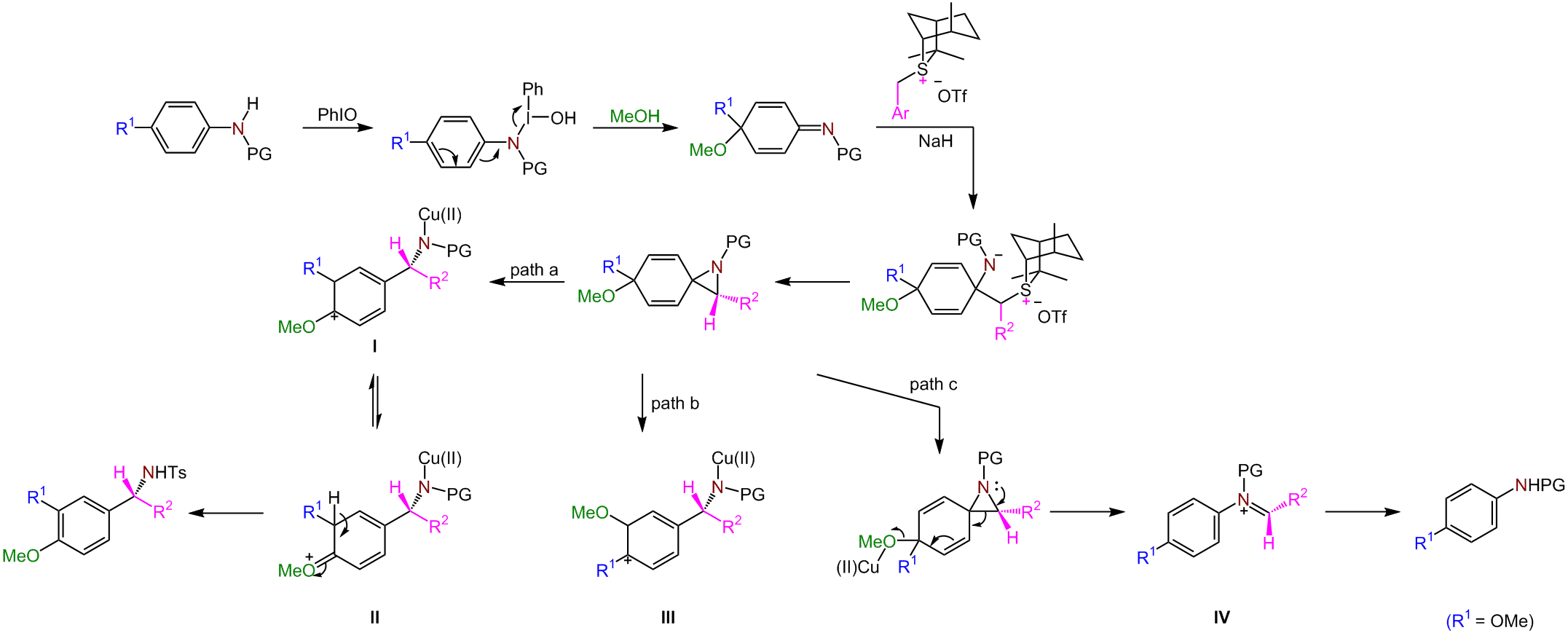
原子对化学键的插入反应由于能同时构建两个新的化学键而成为一种颇具吸引力的有机转化方法。近几十年来,过渡金属催化的非活性化学键原子插入取得了重大进展。插入反应通常涉及过渡金属催化键的断裂和随后不饱和单元的插入。这种优雅的反应已成为一种可以用易得的底物快速构建复杂结构的方法。在这种情况下,将原子插入芳族碳氮键是合成含氮分子的一种极具吸引力的方法。然而,由于这些键具有特别的惰性和稳定性,芳烃碳氮键的直接裂解具有很高的挑战性。尽管可以通过将苯胺转化为更具反应性的中间体(例如芳基重氮盐、芳基铵盐、酰胺或三氮烯)来激活芳香碳氮键,但氮原子通常会随次要产物舍弃。
手性α-支化苄基胺是在多种天然产物和生物活性化合物中发现的重要结构骨架。在活性药物成分价值的驱动下,已建立了芳基金属试剂(包括锂、锌、钛、锡和硼试剂)对醛亚胺的不对称芳基化反应,该方法是合成光学纯苄胺的有效方法。对映选择性单碳插入芳族碳氮键是建立氮取代的苄基立体中心的高效途径,可以满足反应设计中难以达成的需求。
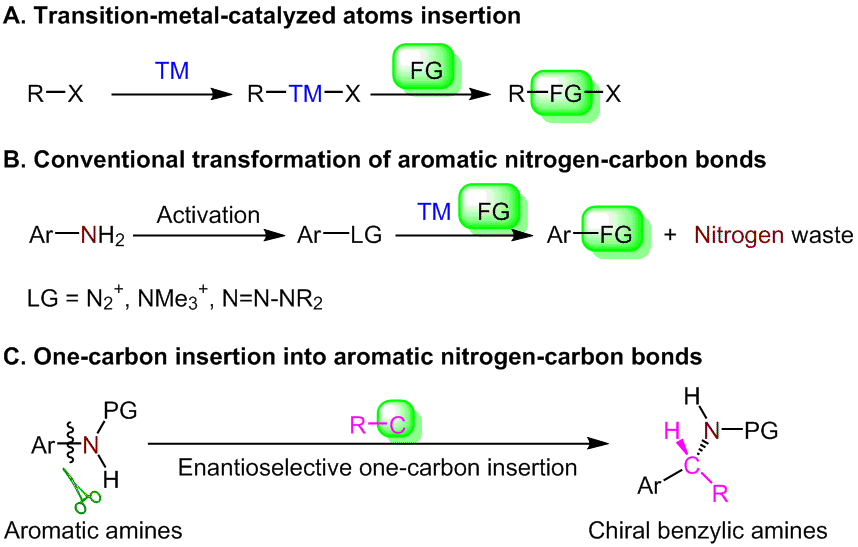
2020年,复旦大学范仁华教授报道了一个对映选择性的芳香族碳氮键单碳插入反应,该反应通过芳香族化合物的分解再组装过程将苯胺转化为高度官能化的手性α-支化苄基胺。该过程涉及对位取代的苯胺的氧化脱芳构化作用,手性硫叶立德介导的不对称叠氮化和随后的重排。手性硫叶立德被用作单碳插入单元。

下图描述了这种转化的可能途径。PhIO介导了对位取代苯胺在甲醇中的氧化脱芳构化反应生成环己二烯亚胺。手性硫醚对环己二烯亚胺的亲核加成和随后的环化产生了螺环中间体。之后发生重排,其驱动力是释放螺环结构的张力。在布朗斯特酸或路易斯酸的作用下,烷基或芳基的迁移形成中间体I (path a),或甲氧基的迁移形成中间体III (path b)。因为中间体I中的正电荷可以通过氧原子(中间体II)稳定,所以优选通过path a重排。最终芳构化可得单碳插入产物。当氨基对位上的取代基为甲氧基时,发生芳构化作用,生成亚胺中间体,但在标准条件下未观察到氮杂环丙烷化和C-C键断裂。 (DOI: 10.1038/s41467-020-18593-4) (推荐人:汤淏,检查人:朱周豪)