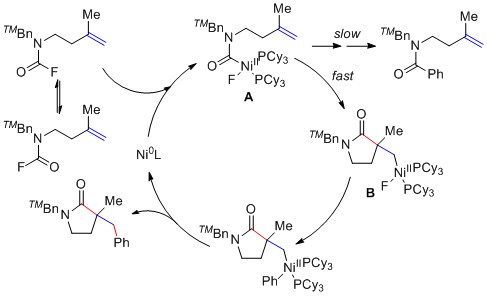
在过去的十年中,由于过渡金属催化的烯烃不对称双官能团化反应为制备手性化合物提供了一条简便、快捷的途径,因此引起了研究人员的极大兴趣。与被广泛研究的活化烯烃相比,非活化烯烃更容易获得,但由于其反应性低和立体选择性难以控制,因而很少被应用。直到最近几年,非活化烯烃的高对映选择性反应才被实现,这大多数是通过芳基金属中间体进行的,当底物中引入芳基时会增强反应活性和选择性(1a)。通过这种策略,一系列含芳基(例如芳基硼、芳基卤化物、芳基重氮盐、芳基酮和芳基腈)的非活化烯烃的对映选择性双碳官能团化反应被实现。
为了打破底物的限制,实现产物结构的多样化,科学家们研究发现还可以通过酰基金属中间体,实现非活化烯烃的对映选择性双碳官能团化反应(1b)。该策略使用原料易得的氨基甲酰基或其类似物作为羰基来源,但是,该策略仅限于活化烯烃(1b),非活化烯烃的对映选择性双碳官能团化反应鲜有报道。2010年,Takemoto等人在底物中引入稳定的氨基甲酰腈来实现非活化烯烃的对映选择性双碳官能团化反应,但反应仅能取得15%的收率和27%的对映选择性。2017年,Douglas等人希望在底物中引入手性基团,通过底物诱导来获得高对映选择性,但很遗憾也仅取得了有限的进展。为了应对这一挑战,2020年,Chen等人在非活化烯烃底物中引入氨基甲酰氯,通过自由基途径和烷基碘化物反应,实现非活化烯烃的高对映选择性还原碳氨甲酰化反应。
近期,南开大学叶萌春课题组首次报道以氨基甲酰氟作为稳定的氨基甲酰源,和芳基硼酸反应,以中等到优秀的收率,实现了非活化烯烃的高对映选择性镍催化的碳氨甲酰化反应,合成了一系列含季碳手性中心的γ-内酰胺(1c)。
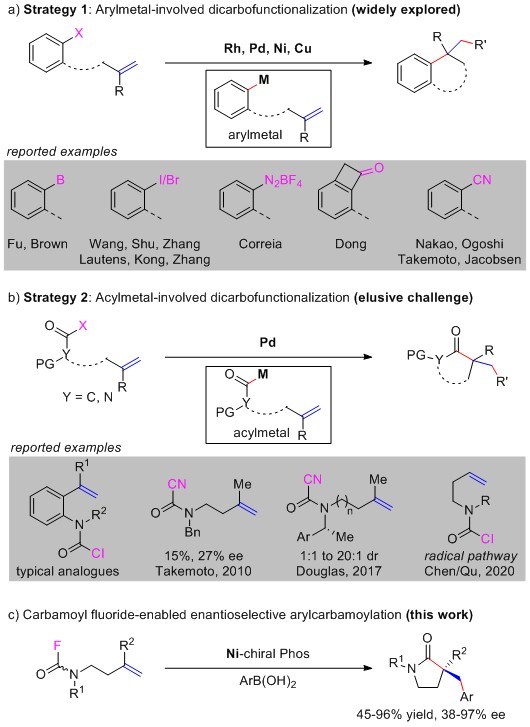
作者在机理实验基础上提出如下反应机理。首先,C-F键和烯基在同侧的氨基甲酰氟异构体作为有利的异构体与Ni(0)发生氧化加成反应,生成中间体A,然后中间体A发生烯烃插入反应,快速环化为中间体B。随后与苯硼酸发生转金属化反应,最后经还原消除得γ-内酰胺。(J. Am. Chem. Soc. 2020, 142, 19844-19849.) (推荐人:王坤,检查人:王晓清)