α-手性羧酸衍生物广泛存在于医药、农用化学品以及天然产物中。迄今为止文献中报道的手性合成α-手性羧酸衍生物的方法主要有以下两种:1)烯烃与有机金属试剂的烯丙基烷基化反应;2)羧酸衍生物的α位官能团化反应。除此之外,理论上也可以通过潜手性烯烃类化合物的加氢羧化反应来制备相应的α-手性羧酸衍生物。但在之前的报道中,当二氧化碳作为亲电试剂参与反应时生成的羧酸中间体极易被还原而获得羟基类化合物。

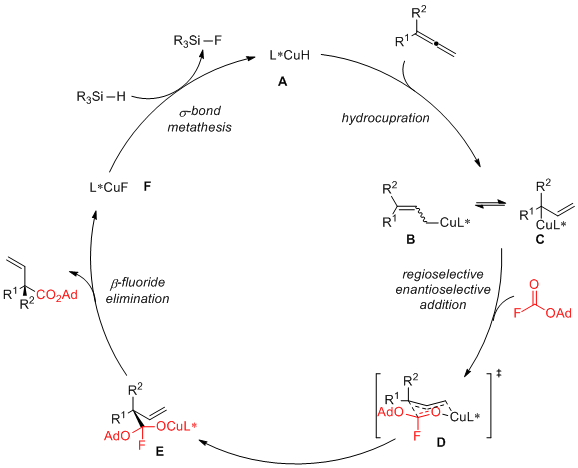
最近,Buchwald小组以氟甲酸酯作为亲电试剂,与联烯发生加氢羧化反应,在较为温和的条件下,可以高区域选择性和对映选择性得到含有季碳或三级碳中心的α-羧酸类衍生物。反应的关键在于亲电试剂氟甲酸酯中氟离去基团的存在,使得反应中间体不易于被还原,从而顺利得到加氢羧化产物。本篇文章列举了17个底物普适性实验,其对映选择性最高达98%,具有较广的底物适用性。
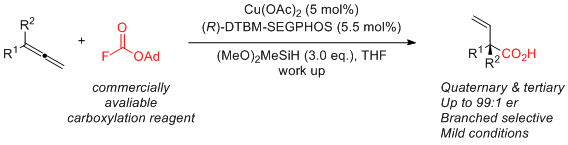
具体反应历程如下:首先底物联烯发生铜氢化反应生成烯丙基铜物种B(物种B可以发生互变异构生成物种C),其中小位阻的末端烯丙基铜物种B可以和氟甲酸酯通过六元环过渡态生成物种E(对映选择性控制步骤),随后物种E发生β-氟消除生成加氢羧化产物及物种F,物种F和硅烷发生σ键复分解再生铜氢物种完成催化循环。(J. Am. Chem. Soc. 2021, 143, 4935) 推荐人:赵 洋, 检查人:李 翔