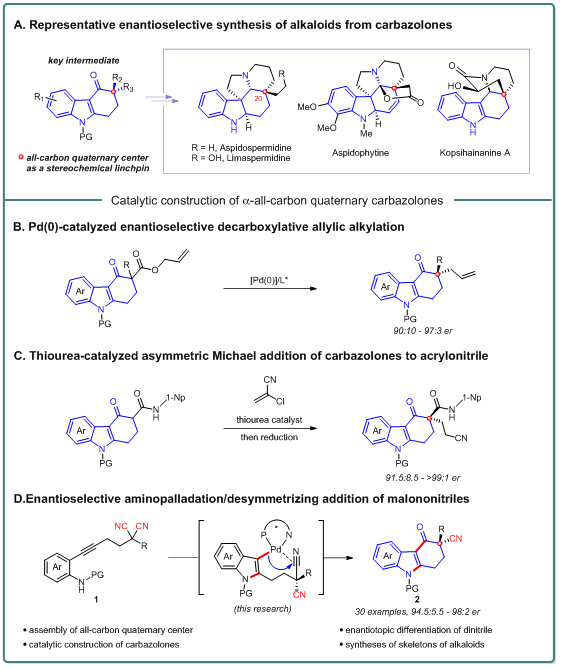
咔唑酮是立体化学丰富的吲哚生物碱中重要的结构骨架。迄今为止,咔唑酮作为全合成中的关键中间体,已经完成了超过10种Aspidosperma和Kopsia生物碱的制备(图1A)。在此类研究中,利用C20全碳四元中心作为立体化学选择性的关键,进而成功构建了多个不同的立体中心,这也显示了对映异构体富集的咔唑酮在合成各种天然产物中存在着巨大潜力。
然而,对于对映选择性合成含α-季碳中心咔唑酮的方法仅有少数报道。主要包含两种类型的不对称催化合成方法:Pd(0)催化的脱羧烯丙基烷基化反应和硫脲催化的Michael加成反应(图1B,C)。但是,由于预先合成咔唑酮中引入的官能团有限,导致方法存在局限性。因此,仍需要发展新的串联方法来实现α-季碳中心咔唑酮的对映选择性合成。受到炔烃亲核钯化反应、碳-杂不饱和键的插入反应以及具有全碳四元中心β-酮腈的合成的启发,作者通过炔烃系丙二腈去对称化策略,成功实现了α-季碳中心咔唑酮的高对映选择性合成(图1D)。
最后,作者提出了可能的反应途径。首先,Pd(II)配合物I与1b中炔烃进行配位,经反式-胺钯化形成物种III。然后,物种III进行分子内亲核加成生成中间体IV,中间体IV质子解产生亚胺V以及再生催化剂I。亚胺V水解形成咔唑酮2b。此外,作者在条件优化过程中,分离了由物种III经质子解形成的副产物3b,这表明钯(II)可能催化3b通过中间体VI的Friedel-Crafts反应形成IV。然而将3b置于标准条件下进行反应时不会生成2b,从而排除这种可能性。(10.1021/jacs.1c00840) (推荐人:刘丽霞,检查人:黄文君)
