手性环戊烯酮是不对称反应中的关键中间体,该结构存在于许多天然产物和药物中。Nazarov环化是一种经典的4π电环化反应,被认为是一步合成手性环戊烯酮的重要方法之一。近些年(近年来),关于Nazarov环化反应的报道已经取得了不错的进展。然而,由于Nazarov环化反应的碳正离子中间体极易发生重排或β-氢消除,故该反应仍面临巨大挑战。通过在二烯酮底物中引入环状烯烃部分,或将给电子基团引入二烯酮的双键之一,将吸电子基团引入另一个导致在带有给电子基团的一侧产生碳正离子,从而确定产物中双键的位置(图1A&B)。但该策略的底物范围都比较局限,且不能有效地合成α-烷基-α'-芳基环戊烯酮(CPK1)、α,α'-二烷基或α,α'-二芳基环戊烯酮(CPK2或CPK3)、α-烯基或α-炔基环戊烯酮(CPK4或CPK5)等α,α'-二取代环戊烯酮(图1C)。因此,发展新的能精确控制Nazarov反应区域和立体选择性的环戊烯酮的合成方法仍然面临巨大挑战。
在1982年,Denmark教授和Jones教授团队就报道了硅导向的Nazarov环化反应。若将硅基团连接到二烯酮底物上则可以利用β-硅效应来稳定碳正离子中间体。这种策略能有效地解决上述中提到的底物范围局限的问题,但硅导向的Nazarov环化反应通常需要等化学当量的强Lewis酸或Brønsted酸来催化反应,且还没有关于硅导向Nazarov环化反应用于合成手性环戊烯酮的报道。基于上述背景研究,南开大学朱守非教授团队报道了手性Brønsted酸和非手性Lewis酸协同催化高对映选择性的硅导向Nazarov环化反应,能以良好的收率和优秀的对映选择性得到一系列α,α'-二取代环戊烯酮(图1D)。

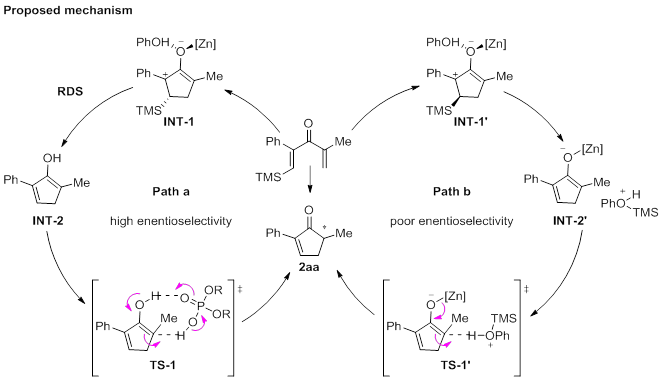
作者提出如下反应机理:底物1aa被Zn(OTf)2和PhOH活化发生4π电环化反应,生成碳正离子烯醇中间体INT-1。其中,TMS相对于络合的苯酚有两种构型分别对应中间体INT-1和INT-1'。在cis-构型(INT-1)中,配位苯酚与TMS会发生分子内亲核反应,转化为烯醇中间体INT-2。最后,在手性SPA作用下,INT-2发生质子转移生成目标产物。在整个催化循环中,由于硅原子的独特电子特性,碳正离子始终保持在甲硅烷基的β位,这是该反应能保持高区域选择性的根本原因。而最后的质子转移过程是该反应对映选择性的决定步骤。同时根据动力学研究结果表明,硅基的消除很可能是反应的决速步骤,并且苯酚和Zn(OTf)2均参与此步骤。当SPA的浓度超过Zn(OTf)2的浓度时,SPA可能会通过络合作用促进Zn(OTf)2从INT-1中解离。虽然SPA没有直接参与决速步骤,但它能显著降低烯醇中间体发生质子转移过程的能垒,从而加快反应速率。但在trans-构型(INT-1')中,反应则会生成烯醇锌和苯酚氧鎓。因为苯酚氧鎓具有强酸性质子,因此无需SPA(TS-1'),苯酚氧鎓就可以直接使烯醇锌质子化,从而导致反应产物的低对映选择性。(J. Am. Chem. Soc. 2021, 143, 6962-6968) (推荐人:黄文君) (检查:刘丽霞)