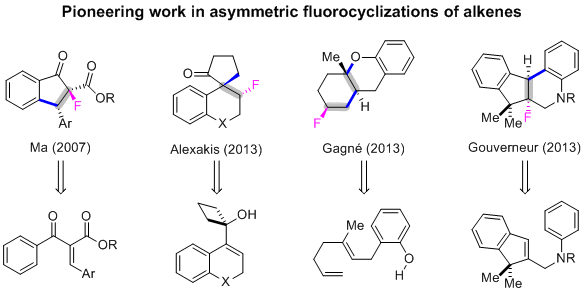
将碳氟键掺入药物分子中通常可以改善其药代动力学特性,包括增加口服生物利用度、蛋白质结合亲和力和代谢稳定性,特别是在替换易于代谢氧化的苄基C-H键的情况下。因此,近年来开发能够对映选择性形成碳氟键的策略已成为具有工业和学术重要性的主要研究领域。特别是,烯烃的分子间1,2-碳氟化是一种有吸引力的转化,因为它允许将烯烃原料转化为氟化分子,在制药、农业化学和材料领域具有潜在应用;然而,由于区域、立体和化学选择性的问题,这种类型的转化仍然具有挑战性。在早期工作中,Ma、Gagné、Alexakis和Gouverneur等课题组报告了前手性烯烃不对称氟环化的例子,其中与烯烃相近的官能团在环化过程中发生反应。
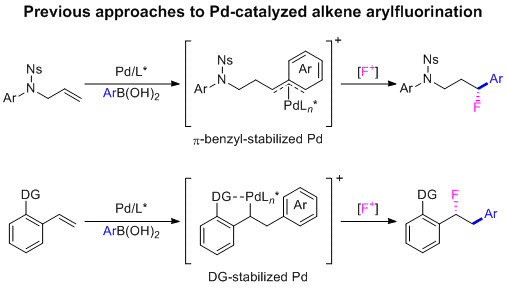
最近,Toste及其同事报道了一系列分子间(三组分)不对称芳基氟化反应,使用钯/N,N-配体系统构建手性苄基氟。该策略用于1,1-芳基氟化(其中区域选择性受底物的电性控制)和1,2-芳基氟化(其中选择性受底物导向控制)。虽然上述工作取得了很大进展,但仍然存在局限性。钯催化的芳基氟化反应对烯烃取代基敏感;例如,双取代烯烃需要双重活化以增强反应性,并且现有方法无法构建完全取代的C(sp3)-F或C(sp3)-Ar立体中心。此外,对于特定的底物(有利于1,2-芳基氟化而不是1,1-芳基氟化、β-氢消除或其他副反应)实现高选择性通常需要广泛的配体优化和使用潜在的合成受限的导向基团。
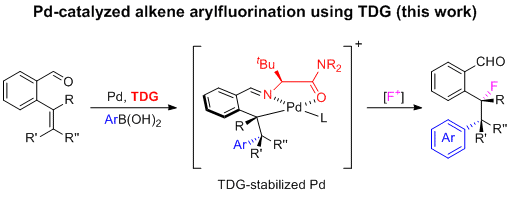
考虑到之前的工作,Engle及其同事设想是否可以通过使用手性瞬态导向策略来解决这些问题。催化瞬态导向基的可行性已经在几种不同机理的过渡金属催化反应中建立,特别是在CH活化领域;然而,瞬态导向不对称烯烃官能化的范围仍然非常有限,使用瞬态导向基方法的1,2-双官能化反应仍然未知。在此,作者报告了烯基苯甲醛的高度对映选择性1,2-芳基氟化反应,它能够形成两个相邻的手性中心,包括完全取代的C(sp3)-F和C(sp3)-Ar立体中心,具有较好的产率和广泛的官能团容忍性。
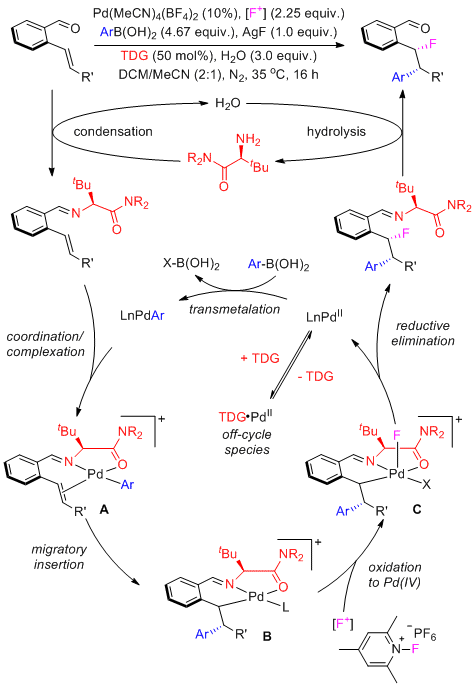
作者提出的机理如下,首先底物通过缩合反应获得手性瞬态导向基,随后和金属钯与硼酸转金属化后生成的芳基钯物种配位络合得到金属钯物种A,紧接着A与底物中的碳碳双键发生迁移插入得到金属钯物种B,随后与氟正离子试剂发生氧化加成得到四价钯物种C,最后还原消除以及水解得到最终的目标产物。(J. Am. Chem. Soc. 2021 ASAP. 10.1021/jacs.1c03178) (推荐人:朱周豪) (检查:丁艺璇)