具有轴手性的苯乙烯类化合物一直以来吸引着人们的注意,因为它们是不对称合成中潜在的手性配体。然而,目前对于该类化合物的不对称合成策略仍然较少,且受到了诸多限制。因此发展不对称构建轴手性苯乙烯类化合物的方法学有着重要的意义和应用价值。
由于轴手性化合物普遍存在于天然产物、生物活性分子及手性配体中,近年来发展了一系列构建轴手性的策略,但这些策略往往局限于联芳烃或联杂环芳烃的合成,并且对于除此之外的轴手性化合物来说,现存的不对称合成方法报道仍较少。轴手性苯乙烯类化合物由于其构型稳定性较差,在不对称合成中一直存在较大的困难。Gu课题组及Smith课题组曾报道了轴手性芳基环己烯类化合物的构建,这类阻旋异构的苯乙烯类化合物与联芳烃有着相似的结构,因此其碳-碳轴的旋转能垒仍是较高的,对比非环状的苯乙烯类化合物来说其合成难度相对较低。
目前主要利用有机催化剂进行轴手性苯乙烯类化合物的不对称合成(图1A上),该方法的关键在于手性联烯中间体的形成,随后该活性中间体被不同的亲核试剂捕获,进而得到多样的轴手性苯乙烯类物质。另一种合成方法是具有前手性苯乙烯类化合物的不对称碳氢键活化,主要使用钯与氨基酸衍生物配体来实现(图1A下)。尽管以上的工作成功为轴手性苯乙烯类物质的构建提供了新的思路和方法,但它们往往只针对于较为特殊的底物,且需要繁琐的合成。
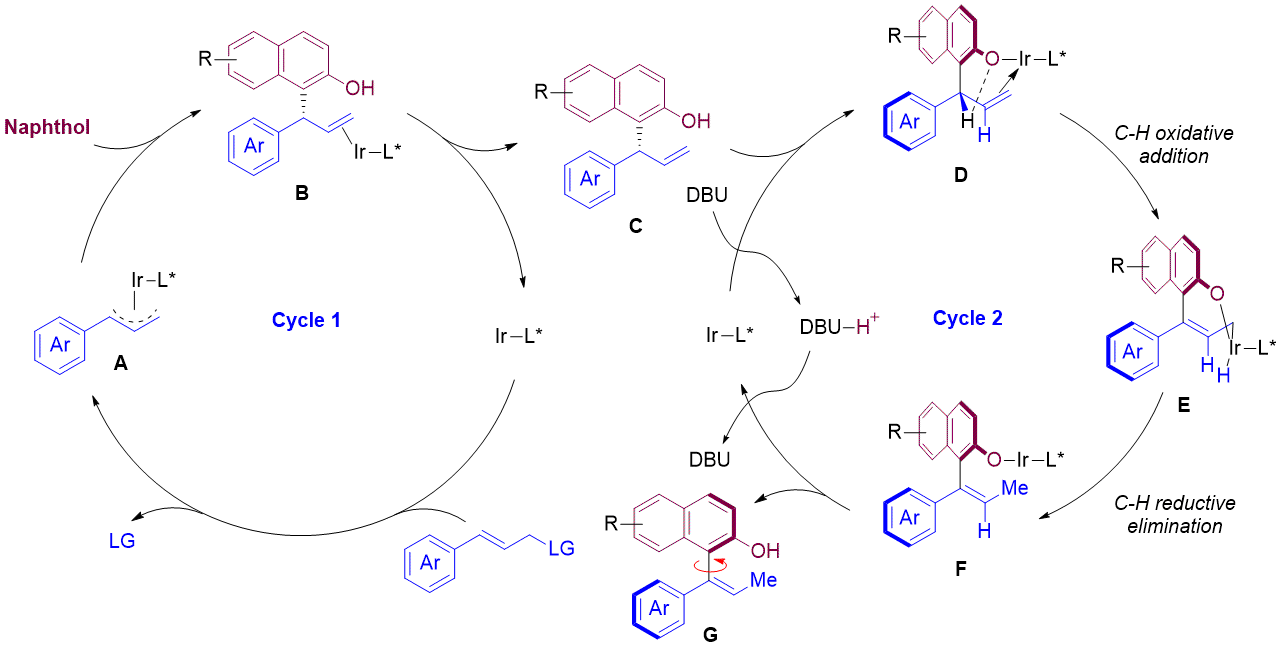
近期,何英课题组基于他们之前提出的中心手性到轴手性的转移策略(图1B),报道了首例通过铱催化的不对称烯丙基取代-异构化串联反应构建轴手性苯乙烯类化合物。作者使用肉桂基碳酸酯类衍生物作为亲电试剂,萘酚作为亲核试剂,在铱的催化下实现了轴手性苯乙烯类衍生物的不对称合成(图1C)。文中共拓展了44个例子,最高可达大于88%的收率和大于99%的ee值。
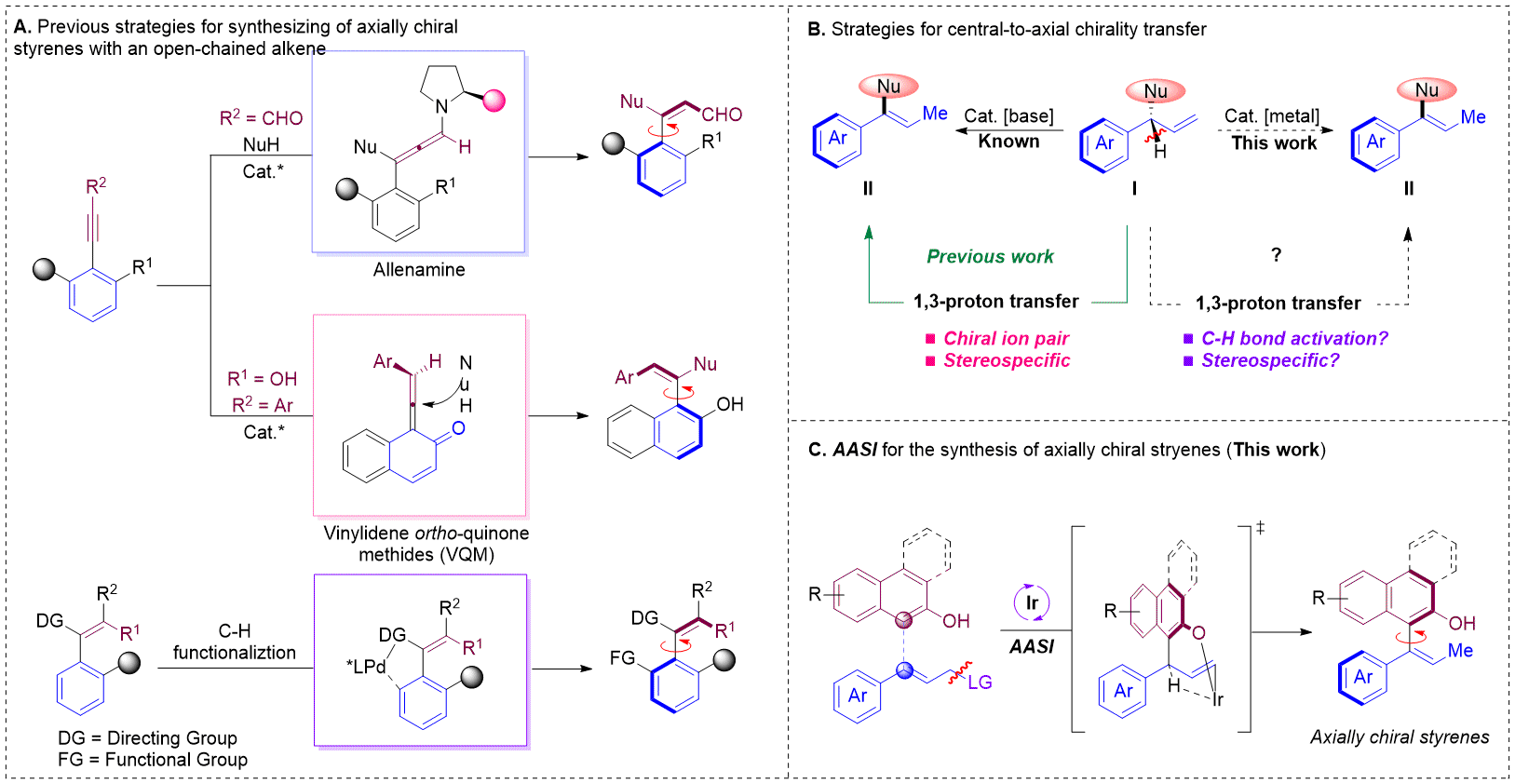
通过机理实验及密度泛函计算,作者推测具体的机理如下(图2),反应过程由两个独立的铱催化循环构成。在催化循环1中进行的是经典的铱催化A与B物种的不对称烯丙基取代反应,能够以高的对映选择性得到C。接着C的酚氧与铱催化剂发生配位并发生碱促进的去质子化得到中间体D,之后发生C-H键氧化加成生成E,中间体E再经过C-H键的还原消除和质子化得到最终产物G,并再生铱催化剂。(J. Am. Chem. Soc. 2021, 143, 10686)(推荐人:牛童,检查人:刘丽霞)