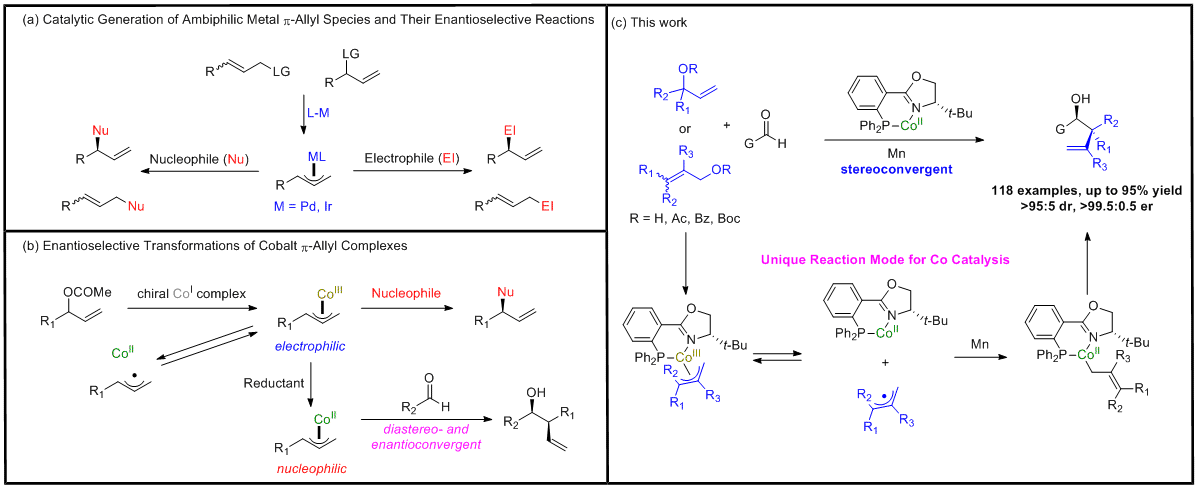
长久以来,利用催化反应不对称生成两亲性π-烯丙基-金属配合物一直都是有机化学研究工作的重点,由于其能从易于获得的烯丙醇衍生物出发,引入多种类的烯丙基而成为了最重要和高效的碳-碳键构建反应之一。尽管在过去的几十年中,亲电 π-烯丙基-金属配合物的催化对映选择性烯丙基取代反应已被深入研究,但将两亲性 π-烯丙基-金属配合物作为亲核试剂用于不对称催化的反应仍未得到充分开发。虽然通过亲核 π-烯丙基-Pd、Ir 和 Ni 配合物对醛和亚胺进行催化对映选择性烯丙基加成的反应近年来已有重大进展,但通过亲电的π-烯丙基-Co配合物的极性翻转策略进行对映选择性的转化依然未被报道。
手性的高烯丙醇是天然产物及药物分子中的重要组成部分,尽管近年来已经开发了由各种过渡金属配合物促进的对映选择性醛烯丙基加成反应,但这些方法都存在显着的局限性,目前仍没有高泛用性的单催化体系能够以高的非对映选择性及对映选择性引入包含叔碳或季碳中心的烯丙基。
2021年,上海有机所孟繁柯课题组报道了利用简单易得的烯丙醇衍生物作为烯丙基前体产生烯丙基-Co(II) 配合物,以商业可得的(S)-t-BuPhox配体与CoI2为催化剂,并以低毒且廉价的Mn粉为还原剂,与醛进行高区域、非对映与对映选择性的加成反应,构建了一系列的β位含有季碳和叔碳中心的高烯丙醇。该反应条件温和,具有很高的立体选择性,且烯丙基前体与醛的底物范围极广,有较高的泛用性。
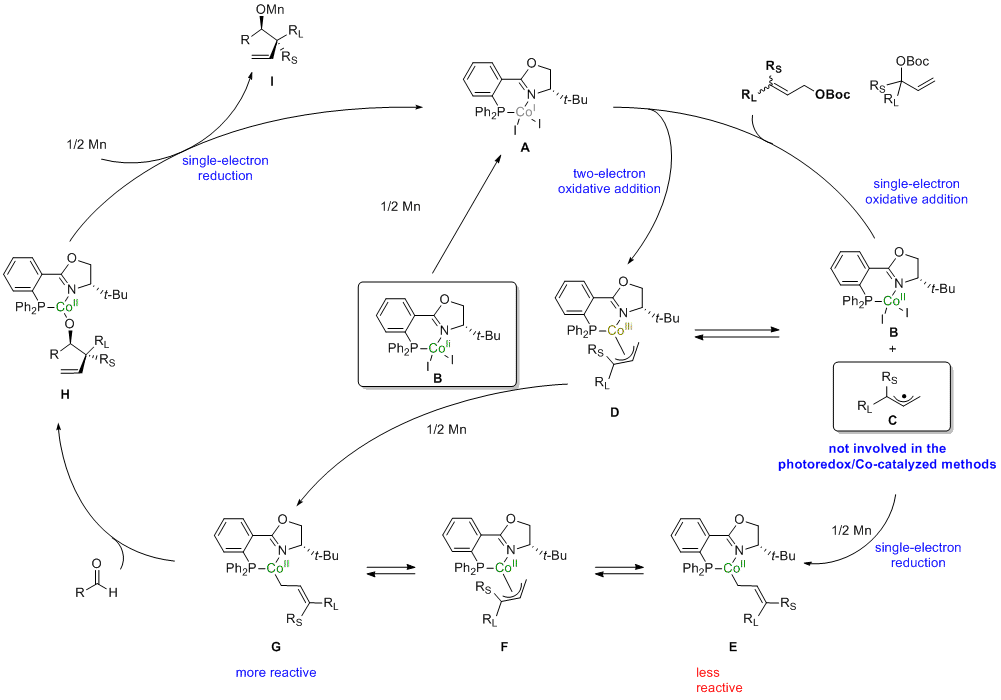
该反应的机理如下:从Co(II)配合物B出发,通过Mn的单电子还原得到Co(I)配合物A,A可经过单电子氧化加成得到Co(II)配合物B与烯丙基自由基C,或者经双电子氧化加成得到π-烯丙基-Co(III)配合物D,而D与B、C之间存在转化平衡;随后B及C在Mn的单电子还原下转化为η1-烯丙基-Co(II)配合物E,其可通过η3-烯丙基-Co(II)配合物中间体F转化为具有更高反应活性的G,或者π-烯丙基-Co(III)配合物D也可以直接通过单电子还原转化为G;η1-烯丙基-Co(II)配合物G与醛发生立体选择性的插入得到H,最后H再发生单电子还原即可得到目标手性产物的Mn盐,同时再生Co(I)配合物A,完成催化循环。(J. Am. Chem. Soc. 2021, 143, 12755, doi.org/10.1021/jacs.1c05690)(推荐人:汤淏) (检查:牛童)