将苄基引入分子中,包括不对称形式,是有机化学的常见反应。传统的亲电苄基化反应,通常涉及SN1或SN2机制介导的苄基卤化物和去芳构化苄基π-烯丙基金属络合物的取代反应。另一种亲核苄基化反应,由于苄基没有相邻官能团活化,苄基C-H不容易去质子化以产生碳负离子。因此,通常使用甲基取代的缺电子杂芳烃或具有强吸电子基的芳烃,并且反应需要过量的强Brønsted碱或Lewis酸活化。以上所述苄基化策略,由于底物的局限性,都大大限制了其结构和功能的多样;同时,不对称反应的例子也较少报道。
四川大学陈应春课题组实现了Pd(0)催化的2-环己酮的Morita-Baylis-Hillman (MBH)碳酸酯不对称形式亲核邻甲酚化反应。该反应具有广泛的底物范围,以及以中等至优良的非对映选择性和对映选择性得到目标产物。此外,文章对催化反应途径也有较好的阐明。
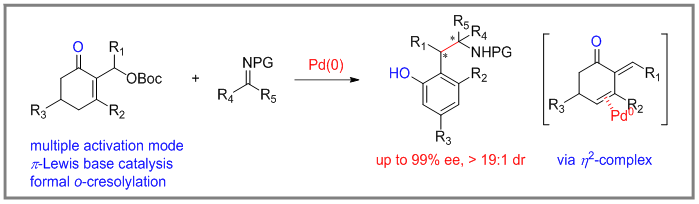
反应机理如下:1a在Pd(0)催化下生成π-烯丙基钯络合物I。络合物I在没有亲核试剂的情况下,会异构化为相应的络合物II,并经过β-H消除,生成一个能以二烯酮与Pd(0)配位的电子中性的η2-络合物III。其中η2-络合物III可以提高烯酮基外-β-C的反应活性。接着,IV经过π-σ-异构化、β-H消除以及芳构化,完成钯催化的不对称形式邻甲酚化反应。

Reference: Song, X.; Zhang, J.; Wu, Y.-X.; Ouyang, Q.; Du, W.;* and Chen, Y.-C.* Asymmetric Formal Nucleophilic o-Cresolylation with Morita-Baylis-Hillman Carbonates of 2-Cyclohexenones via Palladium Catalysis. J. Am. Chem. Soc. 2022, 144, 9564-9569.(推荐人:黄文君,检查人:刘丽霞)