近年来,由于含有手性硅的化合物在理化性质与生物活性方面有着特殊的性质,因此其不对称合成引起化学家们的广泛关注。目前,含有碳或硅手性中心的硅烷类化合物的合成策略已被开发,包括不饱和键的对映选择性氢硅化、前手性硅烷的去对称化和对映选择性硅-氢键插入等。其中,能够同时构建碳手性中心和硅手性中心的策略十分罕见,特别是通过分子间的不同基元反应分别构建每个立体中心的方法在非环状分子更具挑战性,因为柔性的线性分子难以形成有序的过渡态以供手性催化剂构建高的对映选择性。不饱和碳碳键的对映选择性催化氢硅化是合成手性硅烷最直接和最具原子经济的方法之一,但烯烃和炔烃的分子间不对称催化氢硅化构建硅手性中心的工作仍然很少,且这些方法对前手性硅烷的多样性有很大的限制,需要在硅烷上安装特定的取代基。
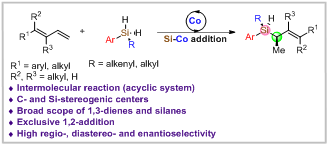
近日,中科院上海有机所孟繁柯课题组报道了钴催化的1,3-共轭二烯的不对称氢硅化反应,高对映选择性和非对映选择性地构建了一系列具有硅中心手性和碳中心手性的非环状手性硅烷。
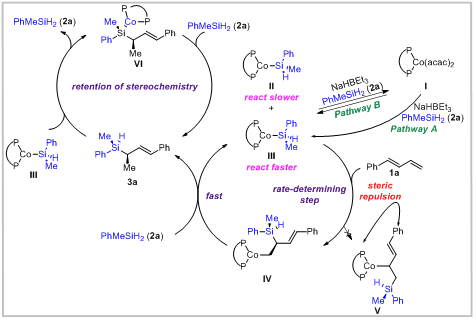
基于实验研究和相关文献报道,作者提出如下机理:手性二价钴催化剂I在NaHBEt3的作用下与硅烷反应,生成硅中心手性的硅钴配合物III(Path A),或者I低非对映选择性的形成两种硅钴配合物II和III,其中一种非对映异构体 III 与 1,3-二烯1a的反应要快得多,通过与硅烷2a的快速σ键复分解,可以将低活性的非对映异构体II转化为两种非对映异构体(II和III)的混合物。随着非对映异构体III的不断消耗,驱动物种II和物种III的平衡向生成物种III的方向进行,即动态动力学转化(Path B)。之后III末端烯烃进行区域选择性加成得到中间体IV,构建碳手性中心,这种区域选择性可能是由于避免了大位阻双膦配体和二取代烯烃部分 (V) 之间更强的空间位阻作用。最后,中间体IV和硅烷2a之间的σ键复分解过程释放产物3a并再生催化活性硅钴物种III。
Reference: Wang, L.; Lu, W.; Zhang, J.; Chong, Q.; Meng, F.* Cobalt-Catalyzed Regio-, Diastereo- and Enantioselective Intermolecular Hydrosilylation of 1,3-Dienes with Prochiral Silanes Angew. Chem. Int. Ed. 2022, 61, e202205624 doi.org/10.1002/anie.202205624(推荐人:汤淏,检查人:李翔)