手性叔醇及其衍生物广泛存在于复杂天然产物和药物分子中。酮类化合物的不对称亲核加成反应是最直接和最有效的构建手性叔醇的方法之一。目前,人们利用铜和手性配体作为催化剂,实现了烯烃与酮的高对映选择性还原偶联,构建了一系列的手性叔醇化合物;而以铬作为催化剂实现手性叔醇构建的例子还鲜有报道。
近日,西湖大学王兆彬教授报道了铬催化酮与炔丙基卤化物的不对称还原偶联反应,该方法能够以良好的收率、区域选择性、非对应选择性和对映选择性获得手性叔醇化合物。该反应可以在温和的条件下通过自由基极性反转的机理进行,具有良好的底物适用范围。
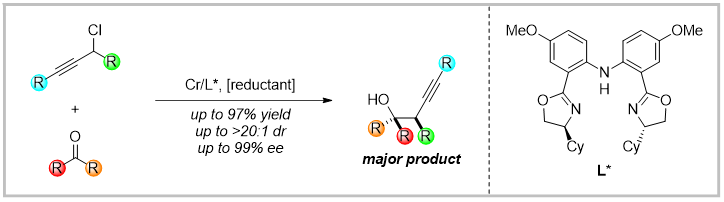
通过机理实验和DFT计算,作者推测了该反应可能的机理:卤素原子在炔丙基卤化物与金属铬之间发生转移,生成炔丙基自由基A。该自由基与二价铬结合,得到具有亲核性的配合物B,此时铬的价态升为三价。随后,中间体B对酮进行亲核进攻,得到中间体C,该步骤是反映的对映选择性控制步骤。在体系中Zr络合物的解离作用下,中间体C转化为具有强Zr-O键的中间体D,D通过水解可得目标产物,体系中的锰粉可以将铬由三价还原至二价,完成催化循环。
Reference: Guo, X.; Shi, Z.; Zhang, F.-H.; Wang, Z.* Cr-Catalyzed Regio‑, Diastereo‑, and Enantioselective Reductive Couplings of Ketones and Propargyl Halides. Acs. Catal. 2023, 13, 3170-3178.(推荐人:陈简;检查人:谢庆贤)