非天然手性α-氨基酸、β-氨基酸衍生物是肽、药物、农用化学品和生物活性天然产物中普遍存在的关键结构。因此,开发普适且具有选择性的合成方法是一直存在的长期目标。特别是对于具有特殊的空间结构及较大的空间位阻效应的α-季碳氨基酸衍生物,其不对称合成尤为困难。在过去几十年其合成的经典方法是使用碳亲核试剂对酮亚胺进行不对称加成。近年来,金属催化烯烃的不对称氢胺化反应成为构建手性胺的重要策略,反应的区域选择性由烯烃的空间位阻效应和电性效应控制,如何实现烯烃氢金属化反应的区域选择性调控是该领域的一大挑战。
近日,舒伟课题组发展了催化剂调控的缺电子烯烃的区域选择性和对映选择性氢胺化反应。通过使用不同的过渡金属催化剂,克服了缺电子烯烃对映选择性氢氨化过程中不利的位阻和电性效应,同时实现了手性α-季碳氨基酸衍生物和β-氨基酰胺衍生物的合成。
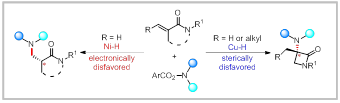
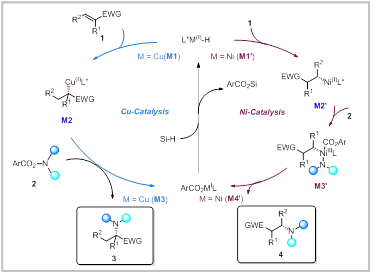
作者利用Cu和Ni催化实现了N,N-二取代丙烯酰胺的加氢胺化反应,成功合成了α-季碳氨基酸衍生物和β-氨基酰胺衍生物,并具有优秀的官能团兼容性和单一的区域选择性。通过一系列机理实验,作者提出了可能的反应机理:在铜催化的体系中,铜氢首先对烯烃进行高选择性马氏加成,生成的烷基铜中间体M2。该中间体与亲电试剂2反应得到α-季碳胺基内酰胺衍生物3和铜络合物M3。在镍催化的反应中,镍氢对烯烃进行高选择性反马氏加成,生成烷基镍中间体M2’。M2’与亲电试剂2发生氧化加成得到三价镍中间体M3’。M3’经历还原消除生成β-氨基酰胺衍生物4和镍络合物M4’。最后,M3和M4’在硅氢的作用下重新生成金属氢物种完成催化循环。
Reference: Wang, S.; Shi, L.; Chen, X.; Shu, W. Catalyst-Controlled Regiodivergent and Enantioselective Formal Hydroamination of N,N-Disubstituted Acrylamides to α-Tertiary-α-Aminolactam and β-Aminoamide Derivatives. Angew. Chem. Int. Ed. 2023, 62, e202303795.(推荐人:赵宝乾;检查人:牛童)