联芳基化合物广泛存在于功能材料、药物和农用化学品,因此开发高效构建联芳基化合物的方法具有重要意义。特别是具有多个邻位取代基的联芳基骨架化合物在新型药物的研发中尤其引人关注。传统上,人们使用过渡金属催化芳基金属试剂与芳基亲电试剂的交叉偶联合成这类骨架,但是,芳基金属试剂的来源及成本限制了其发展。近年来,导向邻位碳氢键芳基化越来越受到关注,其中以铑和钯催化碳氢键芳基化为代表。但是当大位阻芳基卤化物作为芳基亲电试剂时,芳环的碳氢芳基化是难以实现的。最近,Huang小组报道了通过原位制备的钌/富电子菲罗啉催化剂实现的芳基羧酸与大位阻芳基卤化物的交叉偶联反应,能够高效构建一系列多邻位取代的联芳基骨架化合物。
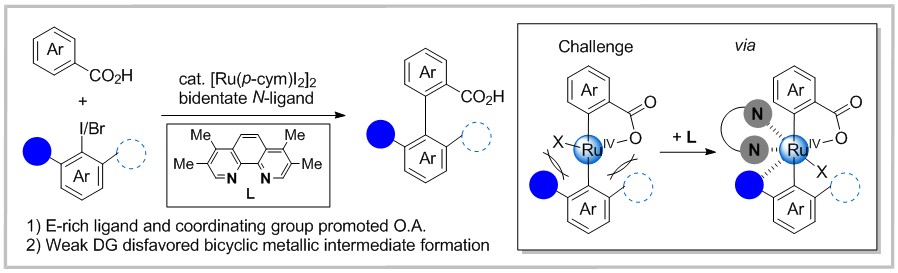
作者通过机理实验与理论计算,提出如下反应机理:金属前体[Ru(p-cym)2]2与配体L在碳酸钾以及配位性溶剂NMP 作用下形成催化物种A1,A1与1-萘甲酸钾发生复分解反应,生成羧酸钌A2,并释放一分子NMP。随后,在碱的辅助下发生分子内碳氢键活化产生环金属中间体A3。紧接着,芳基碘化物2a与A3配位形成中间体A4,并释放出一分子NMP和碳酸氢钾。A4中碳碘键与钌发生氧化加成得到中间体A5,A5与碳酸钾发生复分解反应得到中间体A6,最后经还原消除得到产物3bd,同时在NMP辅助下,再生催化剂A1完成催化循环。

Reference: Luo, X.; Jiang, H.; Huang, L. Ligand-Enabled ortho-Arylation of (hetero)Aromatic Acids with 2,6-Disubstituted Aryl Halides. ACS Catal. 2023, 13, 12104-12113. (推荐人:于艳江,检查人:陈简)