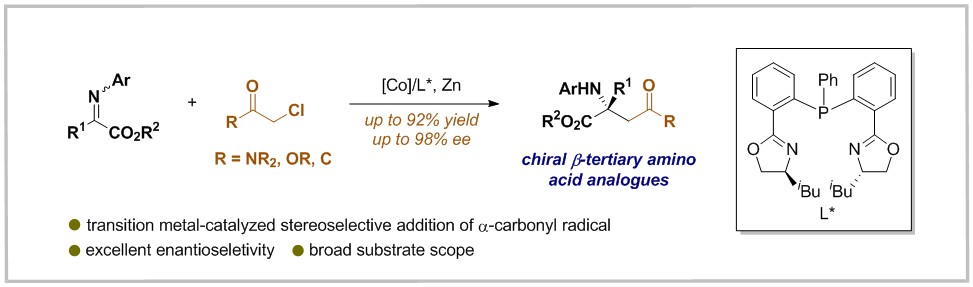
手性β-氨基酸是天然产物、药物分子和生物活性分子的重要结构单元。因此,研究人员致力于该类化合物的不对称合成。虽然手性β-二级氨基酸的构建方法已经取得有效进展,然而手性β-三级氨基酸,因空间位阻的限制,其合成方法依然存在较大的挑战。而利用α-羰基亲电试剂对酮亚胺的自由基加成则为β-三级氨基酸的合成提供了有力的策略。但是,由于α-羰基自由基的高活性以及较短寿命,可能会导致反应的区域选择性和反应性难以控制。
最近,华东理工大学陈宜峰课题组报道了一种钴催化酮亚胺与活性α-氯代羰基化合物的对映选择性还原加成反应,以较好的实验结果合成了一系列手性β-三级氨基酸衍生物。
作者通过相应的机理实验,提出如下可能的反应机理:首先,锌粉还原二价钴为一价钴并与底物1发生配体交换得到Co(I)物种int A;然后int A与α-氯代羰基亲电试剂2通过单电子转移过程,生成int B和α-羰基自由基2’;随后,α-羰基自由基2’与int B发生自由基加成反应,生成的Co(III)物种int C经由Zn0还原,得到Co(II)物种int D;再进行对映选择性加成过程,得到int E,再经质子化、配体交换和Zn0还原,生成目标产物3,同时再生的催化活性的Co(I)物种int A用于下一个催化循环。

Reference: Xia, T.; Qu, J.; Chen, Y. Cobalt-Catalyzed Enantioselective Reductive α-Chloro-Carbonyl Addition of Ketimine to Construct the β-Tertiary Amino Acid Analogues. Angew. Chem. Int. Ed. 2024, e202318991. (推荐人:于艳江,检查人:王高伟)