具有立体轴的手性分子广泛存在于天然生物活性化合物、药物分子和功能材料中。在过去几十年间,阻转选择合成已经有了较大的进展,其中,C-C和C-N轴的不对称构建已被较为广泛地报道。而对映选择性构建N-N阻转异构体的报道则相对较少。因此,发展有效构建N-N轴手性化合物的方法显得尤为重要。
目前报道的N-N轴手性化合物合成方法大致包括去对称化、环化反应、N-烷基化反应及N-酰基化反应等,其基本策略在于引入大位阻基团或环状结构进而限制N-N轴的旋转,从而获得稳定的N-N轴手性。尽管对于以上合成方法的研究已取得了一定的进展,发展更为高效的构建N-N轴手性化合物的方法仍是十分必要的,特别的是,目前报道中的酰化试剂不能实现芳基N-酰化过程。
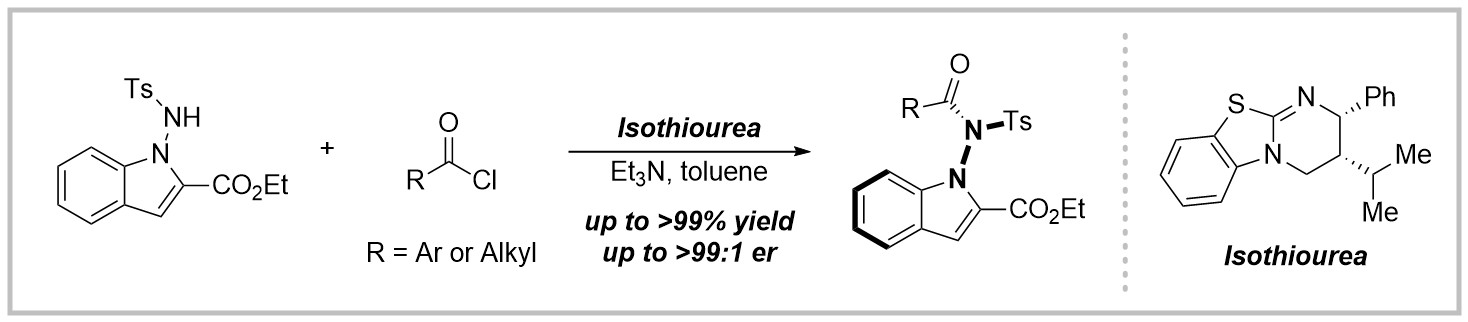
近日,新加坡南洋理工大学/贵州大学池永贵教授报道了一种异硫脲催化的阻转选择性合成具有芳酰胺结构N-N轴手性氨基吲哚类化合物的方法,该方法的困难和亮点在于使用酰氯作为酰化试剂,在过往的研究中,由于酰氯具有高的反应活性,往往很难抑制背景反应,进而导致对映选择性比较困难。在该工作中,作者使用异硫脲作为手性催化剂,酰氯作为酰化试剂,能够以高收率和对映选择性获得N-N轴手性的氨基吲哚,方法有着较广的底物适用范围和官能团兼容性。
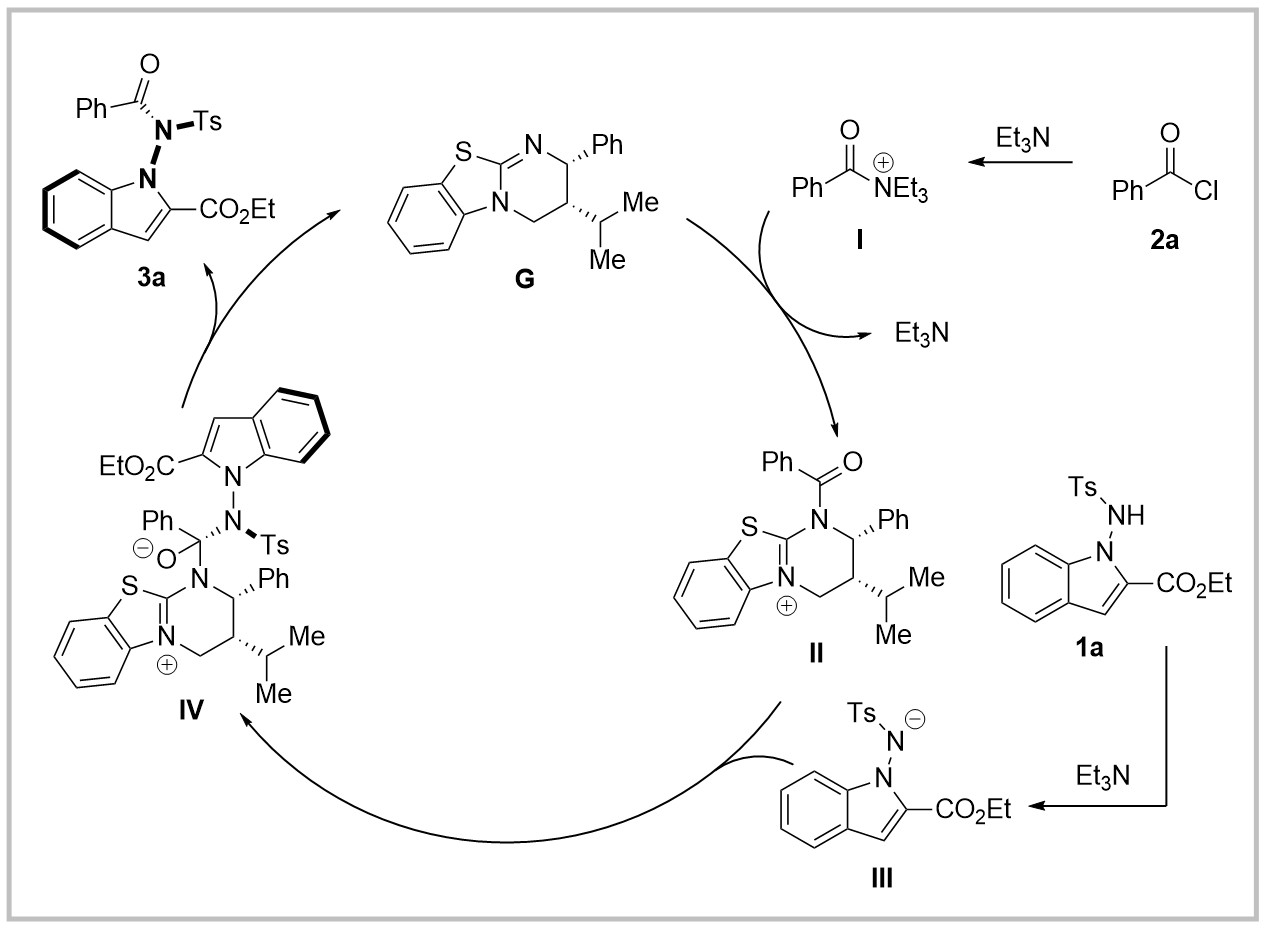
作者通过一系列机理实验提出了如下机理。苯甲酰氯2a首先与三乙胺反应得到酰胺亚胺阳离子I,随后I与异硫脲快速产生中间体II并释放三乙胺,而1a在三乙胺作用下脱质子得到酰胺阴离子III,随后与II反应得到中间体IV,最后脱去异硫脲催化剂得到阻转异构的N-氨基吲哚产物3a并再生催化剂完成催化循环。
Reference: Song, C.; Pang, C.; Deng, Y.; Cai, H.; Gan, X.; Chi, Y. R., Catalytic N-Acylation for Access to N-N Atropisomeric N-Aminoindoles: Choice of Acylation Reagents and Mechanistic Insights. ACS Catal. 2024, 14, 6926. (推荐人:牛童,检查人:赵宝乾)