作为一类重要的合成砌块,邻亚甲基醌被广泛应用于手性含氧骨架的合成中。这其中,邻羟基苄醇在布朗斯特酸的作用下可以很容易的转化为邻亚甲基醌中间体,因此常作为邻亚甲基醌的前体参与反应。目前所报道的以邻羟基苄醇为邻亚甲基醌前体的不对称反应主要有共轭加成反应和(4+2)环合反应,然而邻羟基苄醇参与的不对称(4+3)环合反应却尚未报道。与(4+2)环合反应相比,(4+3)环合反应构建七元环要克服不利的熵因素以及跨环作用。因此,该反应更具有挑战性。
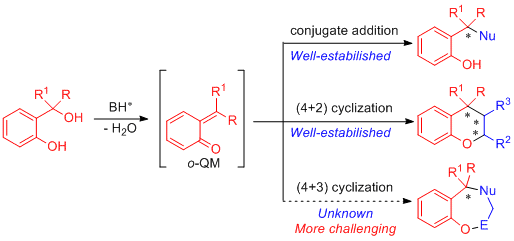
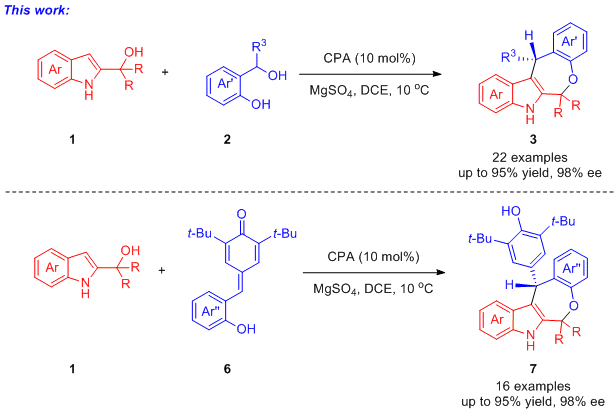
想要实现以邻羟基苄醇为邻亚甲基醌前体的不对称(4+3)环合反应,关键是要找到一个合适三原子合成子,该三原子合成子需要能被手性布朗斯特酸活化并与原位产生的邻亚甲基醌中间体反应。近年来,2-吲哚基甲醇类化合物作为三原子合成子已被应用于不对称催化中。最近,江苏师范大学石枫教授课题组以2-吲哚基甲醇类化合物为三原子合成子,在布朗斯特酸的催化下与邻羟基苄醇反应,首次实现了原位生成的邻亚甲基醌参与的不对称(4+3)环合反应。该反应以高收率和优秀的对映选择性实现了七元大环的构建。此外,对亚甲基醌与2-吲哚基甲醇类化合物的不对称(4+3)环合反应也能取得优秀的结果。
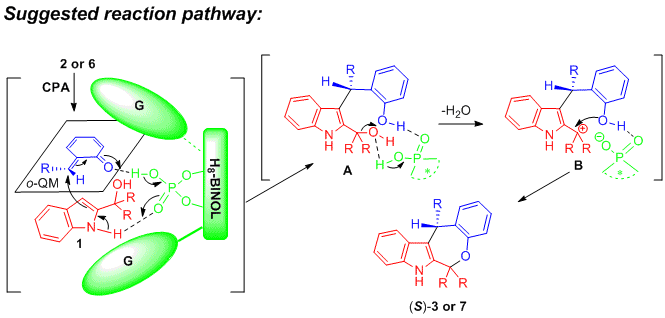
基于对照实验的结果和产物的绝对构型,作者提出了该反应的可能机理。首先,在手性磷酸的作用下,底物2或6原位转化成亚甲基醌中间体。然后,在手性磷酸与亚甲基醌中间体和2-吲哚基甲醇形成的氢键作用下,吲哚三位碳原子对亚甲基醌中间体进行不对称加成反应生成中间体A。之后,在手性磷酸促进下,中间体A脱去羟基生成碳正离子中间体B。最后,在手性磷酸阴离子的促进下,中间体B发生环化,得到S构型的产物3或7。(DOI: 10.1002/anie.201901955)
推荐人:谢焕平
检查人:翟小勇