手性胺在药物,天然产物,精细化学品,农用化学品以及在有机合成中作为试剂或催化剂中是必需的。传统的合成方法依赖于官能团转换,而最近直接通过碳氢键胺化构建碳氮键而没有任何反应性官能团预装的方法引起了很多的关注。其中一种机理认为,中间体金属-氮卡宾或者金属-氮卡宾前体以分布或协同的方式将氮原子插入碳氢键中。虽然已经取得了很大的进展,但仍然存在一个重大的挑战:设计经济的催化不对称体系,使其有效地区分潜手性亚甲基中的两个碳氢键。
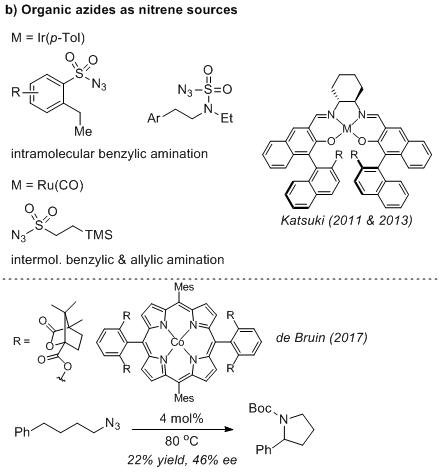
苄基和烯丙基的催化不对称分子间和分子内碳氢键胺化反应所需要的氮源往往需要额外的氧化剂并且原子经济性不高。为了弥补这方面的不足,有机叠氮化物起到了关键的作用,它不需要额外的氧化剂并且分子氮是唯一的副产物。Katsuki课题组分别在2011年、2013年利用手性铱、钌配合物和有机叠氮化合物实现了缺电子金属氮宾的立体选择性碳氢胺化。
烷基氮宾相比较于带有吸电子基团的氮宾中间体更为惰性,所以实现烷基氮宾的碳氢胺化反应也更具挑战性。de Bruin课题组于2017年首次实现了烷基氮宾的立体选择性碳氢胺化反应,但产率和对映选择性均不理想,而且他们的反应体系只适用于一例底物。
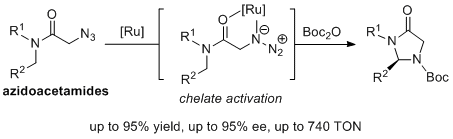
作者选择了较为惰性的烷基叠氮作为氮宾前体,填补了该中间体在高效立体选择性碳氢插入反应方面应用的空白。
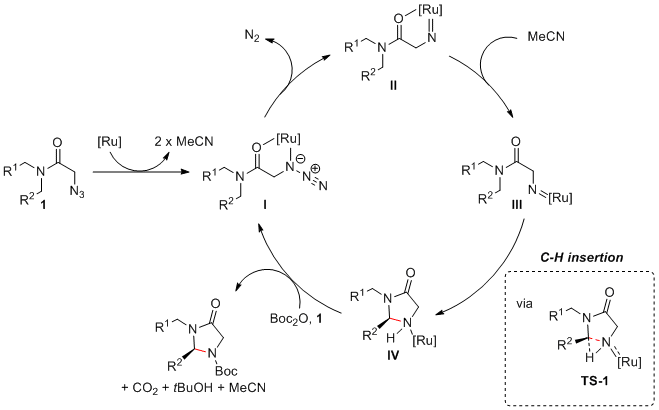
在机理方面,作者认为:首先,叠氮底物通过与钌催化剂配位而得以活化(中间体Ⅰ),释放氮气形成钌氮宾(中间体Ⅱ),在高温下酰胺配位解离,形成有利于碳氢胺化的过渡态(中间体Ⅲ)。随后发生分子内碳氢插入以及Boc保护促进仲胺产物(中间体Ⅳ)离去,解离的钌再与叠氮底物配位,完成整个催化循环。 (Angew. Chem. Int. Ed. 2018, 57, 1-7) (推荐人:朱周豪)