在杂原子N的β位含有立体中心的双环或多环咪唑结构广泛存在于生物活性分子以及手性亲核催化剂中。然而传统合成方法包括缩合以及多步的环修饰策略很难实现β位立体中心的控制。此类化合物更多是通过手性拆分或以手性化合物为起始原料来合成。在2001年,Bergman和Ellman小组报道了铑催化的分子内咪唑与烯烃的碳氢烷基化,为具有β或γ位立体中心的多环咪唑的合成提供了一个有效的途径。然而该方法不适用于构建含有较大位阻基团的β位立体中心,这可能是由于大位阻的β位手性中心需要更加严苛的条件来实现。最近,受到Cavell小组工作的启发,叶萌春小组报道了镍催化路易斯酸活化咪唑的不对称环化,成功构建了具有挑战性的β位手性中心。

通过对三甲基铝的量、配体以及催化剂用量的筛选,最终确定反应的最优条件:Ni(COD)2 (5 mol %)为金属前体,L8 (5 mol %)为配体,三甲基铝(20 mol %)为路易斯酸,甲苯为溶剂。该方法可以实现28个底物的不对称环化反应。反应能以最高98%的收率,大于99%的ee值得到产物。
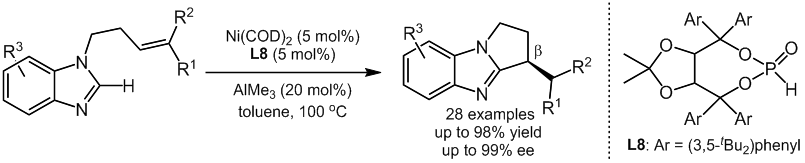
根据氘代实验的结果,作者提出了如下可能的反应机理:(1)首先Ni(COD)2与配体L8和三甲基铝反应生成Ni/Al双金属催化剂;(2)原位制备的催化剂与底物1配位得到中间体A;(3)在路径a中,中间体A经过直接的氢转移,芳环上的氢转移到烯烃上实现关环得到中间体C;(3)而在路径b中,中间体A先经过碳氢键的氧化加成,生成中间体B,接着发生烯烃插入得到中间体C;(4)最后中间体C发生还原消除得到环化产物2和催化剂。(J. Am. Chem. Soc. 2018, 140, 5360.)
推荐人:翟小勇