氰基作为重要的药效团,在医学中扮演着重要的作用。代谢稳定的氰基能促进极性相互作用,加强氢键作用,以及改善了分子的毒理学特征。因此,在药物中越来越多地发现含氰片段。含有氰基的具有全碳立体中心的生物活性化合物,可以防止氰基的α-碳氧化,从而避免有毒的氰化物释放,显得尤为重要。此外,氰基是有机合成中最有用的官能团之一,易于转换为羧酸,醛,胺,噁唑啉,哌啶等。因此,许多优越的催化方法已经被发展,用于合成高光学纯度的具有全碳立体中心的腈类化合物。
去对称化策略已被发展为构建全碳立体中心的有效方法。以双取代丙二腈为原料,对两个氰基去对称化,可以构建高对映体选择性的含氰季碳中心。由于氰基易于和过渡金属配位以及空间尺寸微小,对二个氰基的立体选择极具挑战性。此外,丙二腈类化合物在过渡金属催化剂或有机金属试剂存在下,可能脱氰分解。采用化学的催化方法,对两个氰基去对称化从而构建高对映选择性的含氰季碳中心,目前还没有非常成功的报道。
最近,武汉大学的刘文博课题组报道了一种镍催化对映选择性合成具有全碳立体中心的含氰环烯酮的方法。采用手性的镍作为催化剂,通过硼酸对炔的加成,随后分子内的选择性的环化反应,可以高对映选择性地合成具有全碳立体中心的含氰环烯酮化合物。
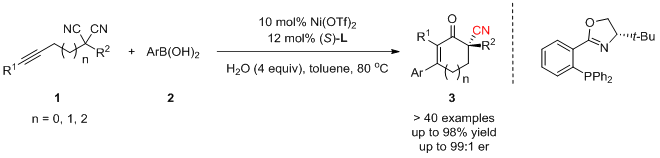
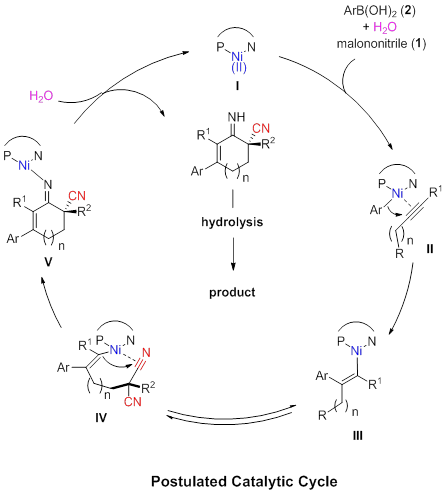
基于前人报道,作者提出了可能的反应机理:首先,镍配合物I和硼酸转金属化生成芳基镍物种II,并和化合物1中的炔基配位;随后炔基插入碳镍键,生成顺式的烯基镍III;III可以异构化为物种IV;IV在手性环境下对一个氰基选择性的加成,生成手性的物种V;最后,V质子解生成亚胺和具有活性的镍配合物I,完成催化循环。亚胺进一步水解,得到手性的环己烯酮化合物3。(DOI: 10.1021/jacs.0c02075) (推荐人:王新维) (检查:李翔)