碳硼键在有机化学中非常有用,可以被诱导参与许多反应,从而形成碳碳键和碳杂原子键。尽管芳香族碳硼键的反应性较为成熟,已广泛应用于化学应用的所有领域,但脂肪族碳硼键的生成和反应仍然是有机合成中日益发展的一个方向。Brown开创了烷基硼物种的常规合成和使用方法,使烯烃与硼烷反应生成烷基硼物种,然后可以将其氧化生成醇。在这种经典的转化中,烯烃的碳碳双键容易与亲电硼烷反应生成烷基硼物种。该转变依赖于烯烃中π键的富电子和反应性,因此当使用烷烃σ键作为底物时无法进行。
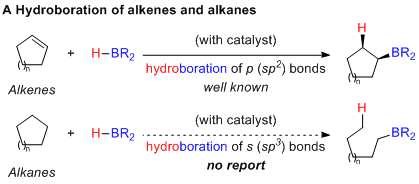
化学家尝试在Csp3-B键的产生中解决这个问题,得到了格氏试剂(Csp3-X通过Csp3-MgX生成Csp3-B)的硼化和C-H键的直接硼化(Csp3-H到Csp3-B)的产物。此外,认识到烷基硼酸酯中间体在有机合成中的重要性,还开发了许多过渡金属催化的烯烃的硼氢化反应。尽管这些方法扩大了硼化学的范围,但作者推测烷烃的硼氢化将是生成Csp3-B键的更直接方法,同时生成的烷基硼产物可能与传统的硼氢化不同。然而,该假设因碳碳σ键缺乏碳碳双键的π键的反应性,因此没有与硼烷反应。仅当在相邻的π键的引导下,极度张力的σ键被迫与硼烷反应时,此规则才可以适用。最近,一些化学家报道了铱催化的环丙烷的C-H硼化。环丙烷与具有二齿氮配体3,4,7,8-四甲基菲啰啉的铱配合物反应,使环丙烷发生碳氢键的活化作用,从而获得了硼化的环丙烷。
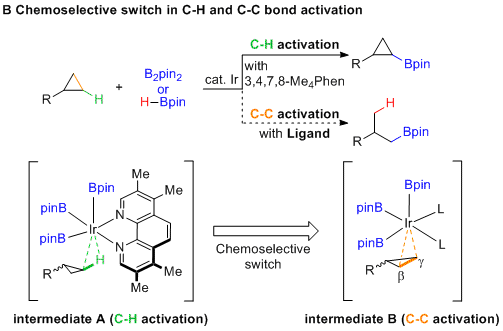
如果使用合适的配体,则可能会实现从中间体A到中间体B的“化学选择性转换”,其中C-C活化的选择性可以通过催化剂与空间位阻较小的Cβ-Cγ键反应实现。考虑到这些目标,作者进行了广泛的配体筛选,并通过使用t-BuQuinox实现了首次由铱催化的环丙烷的σ键硼氢化反应。

下图是环丙烷的氢硼化以及环丙烷的C-H硼化的合理机理。图中所产生的Ir络合物A可以与H-Bpin反应,然后通过释放氢气分子来再生催化剂B。作者通过计算发现5-配位的Ir配合物B是这两个反应的活性催化剂。单取代的环丙烷1的Cβ-Cγ键对Ir配合物B的氧化加成生成中间体C,随后通过该中间体的还原消除生成配合物D。从D开始,存在三种途径得到彼此之间平衡存在的络合物E,D'和D''。络合物E通过还原消除可以获得氢硼化的产物2,并再生催化剂B。络合物D'和D''则通过类似的途径可以得到产物2。(DOI: 10.1021/jacs.0c05213) (推荐人:朱周豪) (检查:丁艺璇)