过渡金属催化的将C(sp3)–H键转化为新的化学官能团的方法是一项新兴的技术,具有简化化学合成的潜力。许多C(sp3)–H官能化策略的一项重要特征是使用配位基团,这种配位基团将金属催化剂置于特定的C–H键附近,从而能够使反应具有活性和选择性。在理想情况下,分子中存在的官能团将能够通过环金属化实现C(sp3)–H活化。不过,这样的例子是很少见的。更常见的是分子中已有的功能团需要附加的导向基来调整其配位能力。尽管这种辅助增强的C(sp3)–H活化策略有效,但仍然存在许多缺陷。首先,导向基需要先移入分子而后在C–H转化之后移除; 其次,移除导向基有时可能需要苛刻的反应条件,可能破坏分子结构;再次,最引人注目的限制是如果分子中没有特定的官能团,辅助增强的C(sp3)–H活化策略就不能完成。烷基叔胺中因为没有简单的方法引入和移除导向基,通过辅助增强的活化策略很难实现C(sp3)–H活化。
最近,Gaunt课题组报告了Pd(II)催化的烷基叔胺的C(sp3)–H官能化,通过简单的配体可以协调C–H活化步骤,将简单或复杂的原料转化为一系列γ-芳基烷基叔胺。作者提出以下可能的反应机理:烷基叔胺与Pd(II)催化剂配位,形成Int-I;随后发生C-H键活化得到环钯物种Int-II;该化合物与芳基硼酸发生转金属化生成Int-III;最后可能在苯醌促进下反式还原消除生成产物和Pd(0);Pd(0)随后被Ag(I)氧化重生Pd(II)催化剂。

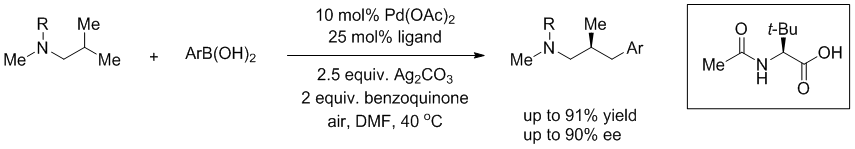
由于在反应中使用手性的配体,作者也尝试是否可以实现手性转化 。通过对异丙基去对称化,可以合成手性的β-甲基-γ-芳基丙胺衍生物,最高可以取得91%的收率和90%的ee值。(Gaunt, M. J. et al. Nat. Chem. 2020, 12, 76.) (推荐人:王新维) (检查人:李翔)