缺电子杂环氮杂二烯的逆电子Diels-Alder环加成反应是合成高度官能化杂环的有效方法,该杂环可被广泛用于有机合成,药物化学和化学生物学中。目前报道杂环氮杂二烯的环加成反应底物包括1,2,4,5-四嗪,1,2,4-三嗪,1,3,5-三嗪,1,3,4-恶二唑,1,2-二嗪,1,2,3-三嗪和1,2,3,5-四嗪等,其中1,2,4,5-四嗪类底物方便易得,发生环加成反应的活性高。文献中关于1,2,4,5-四嗪的3,6-环加成反应(2个碳原子位点发生反应)有过多次报道,但关于1,2,4,5-四嗪1,4环加成反应(2个氮原子位点发生反应)鲜有报道,优先在2个碳原子位点发生反应而非在氮原子位点反应,这是由于在形成两个C-C键后释放N2相对于形成两个C-N键释放腈在能量上更有利。
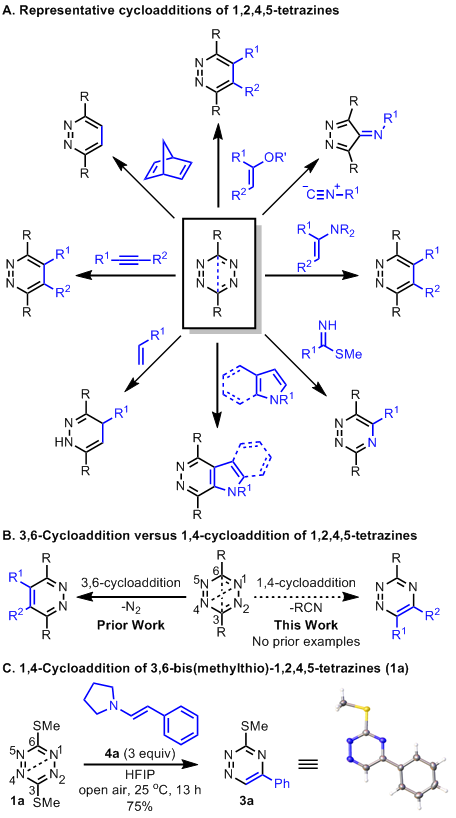
Boger课题组近来实现了1,2,4,5-四嗪的1,4环加成反应,特别的是他们在反应中使用六氟异丙醇作为溶剂,通过1H NMR机理研究发现,1,2,4,5-四嗪这类杂环氮杂二烯的碱性弱,六氟异丙醇(HFIP)对其具有独特的氢键辅助催化作用。
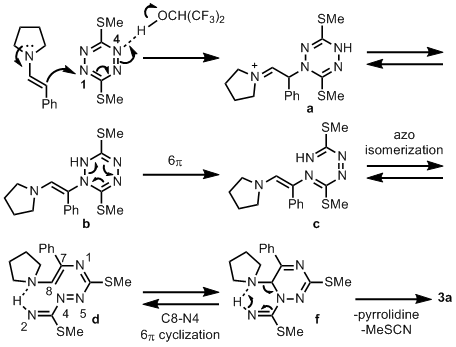
作者提出了如图反应机理:在六氟异丙醇溶剂作用下3,6-二甲硫基1,2,4,5-四嗪被氢键活化,N1发生烯胺亲核进攻,生成中间体a,中间体a脱除质子经互变异构生成中间体b,中间体b发生6π电子重排从而氮氮键断裂生成中间体c,随后经过顺反偶氮异构化生成中间体d,中间体d经过6π电环化(C8-N4成键)生成f,中间体f通过六元过渡态实现芳构化,一分子吡咯及一分子硫代甲基氰酸酯(MeSCN)离去,生成终产物3a。 (J. Am. Chem. Soc. 2020, 142, 20778-20787) (推荐人:于艳江,检查人:赵洋)