催化不对称氢化作为引入手性中心的常用方法,在不对称过渡金属催化反应中占有非常重要的地位。而在烯烃的不对称氢化中,四取代烯烃的研究相对较少。成功实现不对称氢化的烯烃底物局限于含有芳基取代基的共轭烯烃、α,β-共轭羧酸或羧酸酯以及烯酰胺。2016年,Christensen小组利用钌/二茂铁催化剂实现了α-甲基-β-环丙基肉桂酸甲酯的不对称氢化,取得98%的ee值。在该催化体系下,需要较高的温度和氢气压力。由于烯基环丙烷基团在铑体系中不稳定,所以不能实现铑催化该底物的氢化。最近,Takacs小组对该底物进行变化,实现了温和条件下铑催化的肟导向的三/四取代烯烃的不对称氢化。
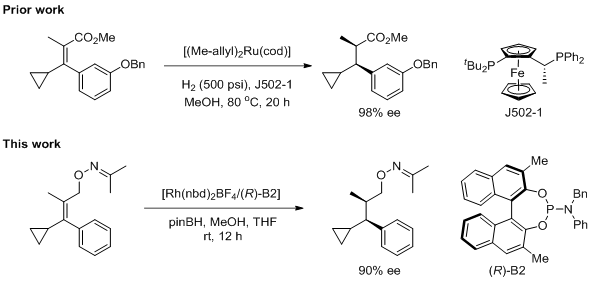
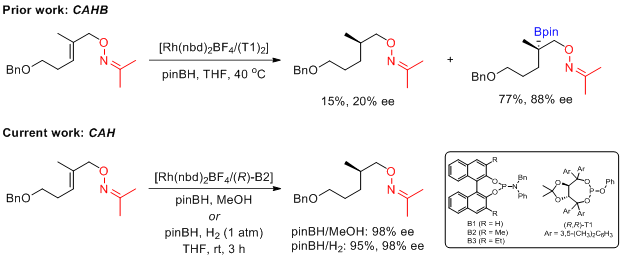
在过去的研究中,催化不对称硼氢化反应常常得到硼化物。而在Takacs小组报道的烯烃的不对称氢化反应中,加入当量的频那醇硼烷得到的是直接还原的产物,并未发现硼化物的生成。值得注意的是,该氢化的氢源是频那醇硼烷和甲醇原位生成氢气。此外,采用氢气作为氢源,对四取代烯烃进行不对称氢化也适用,但反应需要加入频那醇硼烷,否则反应不发生。
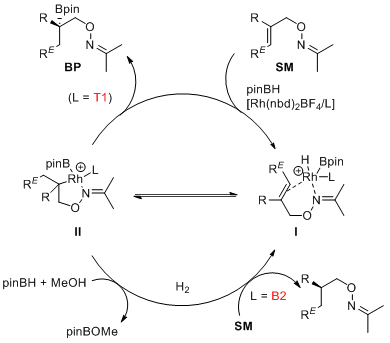
最后,作者就不对称氢化和不对称硼氢化的竞争过程给出了描述。反应首先是铑对硼烷进行氧化加成并与烯烃底物进行配位得到中间体I。烯烃插入到Rh-H键得到中间体II。一方面,中间体II直接还原消除得到硼化产物BP。另一方面,中间体II与原位产生的氢气发生复分解反应得到直接还原产物RP。(J. Am. Chem. Soc. 2017, 139, 5740.)
推荐人:胡书博