手性α-氨基酮类化合物广泛存在于天然产物、药物分子中;同时也是合成高附加值手性结构的重要合成前体。手性α-氨基酮的传统合成路线通常依赖多步反应从特定前体逐步修饰获得,存在步骤繁琐、合成效率低、经济性差等局限。近十年来,过渡金属催化的还原交叉偶联反应因其仅需使用当量亲电试剂、无需化学计量金属试剂的独特优势,已成为构建C–C键的重要工具。镍催化两种烷基亲电试剂的还原偶联可以构建C(sp3)–C(sp3)键。在CO或其等价物存在下则可实现还原条件下二烷基酮的合成。然而,这些策略需使用过量还原剂和当量烷基亲电试剂。因此,发展氧化还原中性条件下合成二烷基酮的新方法具有重要价值。
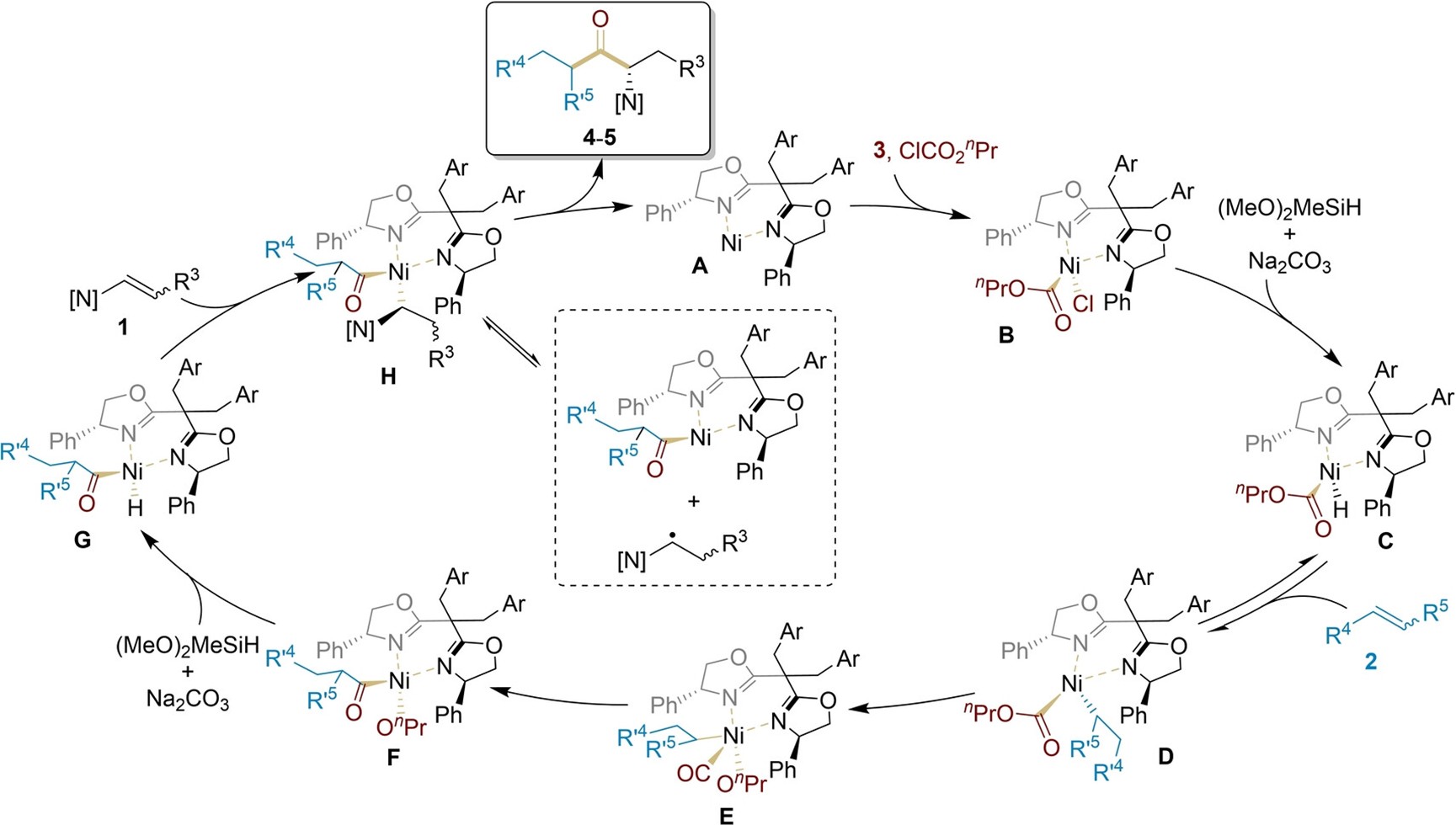
近期,南方科技大学舒伟课题组组发展了N-酰基烯胺与非活化烯烃的不对称偶联的新模式,通过对两组分烯烃的选择性氢羰基化策略实现手性α-N-杂芳基酮的构建。值得一提的是,该反应在氧化还原中性条件下进行,氯甲酸酯既作为羰基的替代物,也作为电子受体来实现反应的氧化还原中性。两种烯烃分别作为一级烷基亲电试剂和N-邻位二级烷基亲电试剂的前体。首次实现无需使用当量的烷基亲核试剂,也无需使用当量的烷基亲电试剂不对称合成α-N-杂芳基二烷基酮。
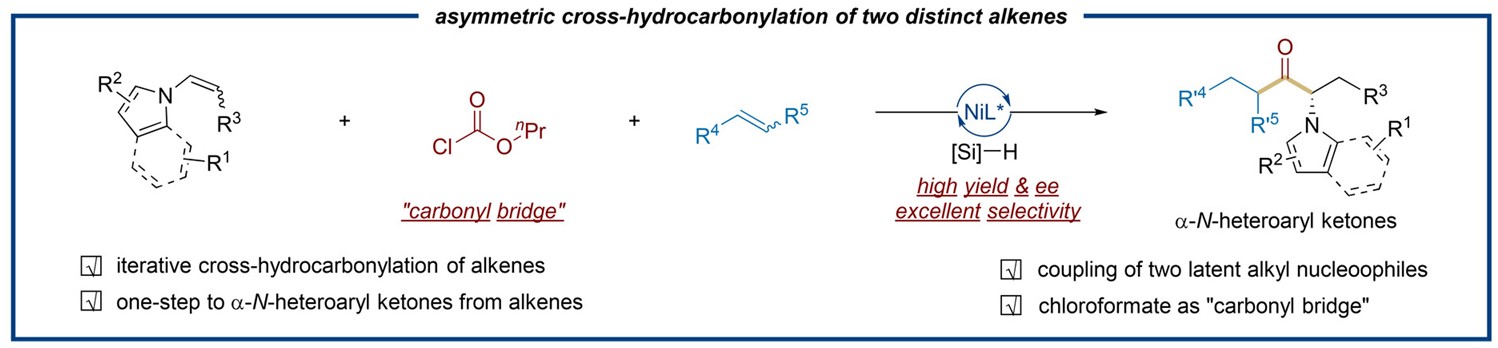
基于初步的机理实验结果和有关文献报道,作者提出了反应的可能机理。首先,配体配位的零价镍物种(A)与ClCO2nPr(3)发生氧化加成生成Ni(II)中间体(B)。在Na2CO3存在下,B与(MeO)2MeSiH发生转金属化生成镍氢物种(C),随后与非活化烯烃(2)进行可逆的迁移插入,形成烷基-Ni(II)物种(D)。D挤出羰基生成中间体(E)。烷基与配位的一氧化碳发生分子内迁移插入,生成酰基Ni(II)中间体(F)。F在碱的作用下与(MeO)2MeSiH再次发生转金属化反应,形成酰基Ni(II)-H物种(G)。G与N-烯基杂芳烃(1)发生区域选择性和对映选择性的氢金属化反应,生成酰基Ni(II)-烷基中间体(H)。Ni(II)中间体H可能通过Ni−C键的均裂快速生成酰基Ni(I)和烷基自由基。该可逆过程能够进一步提高反应的对映选择性。H经还原消除生成最终产物(4- 5),并再生Ni(0)物种(A),完成催化循环。
Reference: Chen, X.-Y.; Yu, Q.; Shu, W. Synthesis of α-N-Heteroaryl Ketones by Nickel-Catalyzed Chemo-, Regio- and Enantioselective Carbonylation of Alkenes and N-Alkenyl Heteroarenes. Angew. Chem. Int. Ed., 2025, 63, e202423426.(推荐人:杨宇,检查人:展昕宇,时间:2025年5月27日)